https://pmc.ncbi.nlm.nih.gov/articles/PMC10619990
Rambam Maimónides Med J. 29 de octubre de 2023;14(4):e0022. doi:
Cannabis y artritis reumatoide: una revisión exploratoria que evalúa los beneficios, los riesgos y las futuras direcciones de investigación
Nicole Paland 1 , Haya Hamza 1 , Antonina Pechkovsky 1 , Miran Aswad 1 , Dayana Shagidov 1 , Igal Louria-Hayon 1, 2, *
- Información del autor
- Notas del artículo
- Información sobre derechos de autor y licencias
ID de producto: PMC10619990 ID de producto:
Abstracto
Las enfermedades reumatoides, como la artritis reumatoide, la osteoartritis y la fibromialgia, se caracterizan por una inflamación progresiva del sistema musculoesquelético, que afecta predominantemente a las articulaciones y provoca daño en el cartílago y los huesos. El dolor resultante y el deterioro continuo del sistema musculoesquelético contribuyen a la reducción de la actividad física, lo que en última instancia afecta la calidad de vida e impone una carga socioeconómica considerable. Desafortunadamente, las terapias actuales tienen una eficacia limitada para ralentizar la progresión de la enfermedad y controlar el dolor. Por lo tanto, el desarrollo de terapias nuevas y alternativas es imperativo. Los cannabinoides poseen propiedades beneficiosas como posibles tratamientos para las enfermedades reumatoides gracias a sus propiedades antiinflamatorias y analgésicas. Estudios preclínicos han demostrado resultados prometedores en la detención de la progresión de la enfermedad y el alivio del dolor. Sin embargo, hay escasez de estudios clínicos con pacientes, y los datos disponibles muestran resultados contradictorios. En consecuencia, actualmente no existen recomendaciones clínicas establecidas sobre el uso de cannabis para el tratamiento de las enfermedades reumatoides. En esta revisión, nuestro objetivo es explorar el concepto del uso de cannabis para las enfermedades reumatoides, incluyendo sus posibles efectos adversos. Ofreceremos una visión general de los datos obtenidos de ensayos preclínicos y clínicos y de estudios retrospectivos sobre la eficacia y seguridad del cannabis en el tratamiento de enfermedades reumatoides.
Palabras clave: Enfermedad autoinmune, cannabis, CBD, inflamación, artritis reumatoide, THC
INTRODUCCIÓN
Las enfermedades reumatoides se caracterizan por una inflamación crónica progresiva del sistema musculoesquelético, que afecta principalmente a las articulaciones, pero puede provocar comorbilidades sistémicas, como enfermedades pulmonares o vasculitis. La inflamación crónica provoca daño en el cartílago y los huesos, cuyo deterioro puede causar discapacidad al paciente afectado. 1
Las enfermedades reumatoides suponen una carga significativa tanto para el individuo como para la sociedad. El dolor y los déficits musculoesqueléticos provocan una disminución progresiva de la actividad física y la calidad de vida, y conllevan el riesgo de comorbilidades acumulativas. 2 Además, los costes médicos del tratamiento, así como la reducción de la capacidad laboral y la menor participación social de los pacientes con artritis reumatoide (AR), tienen un impacto socioeconómico significativo en la sociedad. 3
El tratamiento de la enfermedad reumatoide es un desafío no solo por su naturaleza progresiva, sino también por los efectos secundarios de las terapias disponibles. 4 Además, las opciones de tratamiento disponibles no pueden revertir las enfermedades reumatoides. Por lo tanto, los esfuerzos terapéuticos se dividen en medicina preventiva (inicio del tratamiento antes de la manifestación clínica) y desarrollo de nuevos fármacos. Actualmente, existen tres clases de fármacos: (1) fármacos antirreumáticos modificadores de la enfermedad (FARME), que actúan sobre el factor de necrosis tumoral (TNF)-α, el receptor de la interleucina (IL)-6, y estimulan la depleción de células T y B, ralentizando así la progresión del daño estructural; 5 , 6 (2) fármacos antiinflamatorios no esteroideos, que mejoran la función física al reducir el dolor y la rigidez, pero no modifican la progresión de la enfermedad; 4 y (3) glucocorticosteroides, que tienen un rápido efecto sintomático y modificador de la enfermedad. 7
El uso prolongado de glucocorticoides y FAME presenta efectos adversos graves a largo plazo. 8 , 9 Además, los pacientes tratados con FAME biológicos presentan un mayor riesgo de infecciones graves por tuberculosis y virus del herpes zóster, así como un mayor riesgo de desarrollar melanoma. 10 Esto ejemplifica la necesidad de nuevos enfoques terapéuticos y terapias seguras. Un enfoque es el uso de cannabis medicinal, que aprovecha sus propiedades analgésicas e inmunomoduladoras.
CANNABIS Y CANNABINOIDES
El cannabis es la droga ilícita más consumida en el mundo. El cannabis no es una sustancia única, sino que consta de más de 550 componentes químicos diferentes acumulados en la planta de cannabis, entre ellos aproximadamente 150 cannabinoides psicoactivos y no psicoactivos y más de 400 no cannabinoides. La planta de cannabis ( Cannabis sativa ) pertenece a la familia Cannabaceae. Hay dos formas principales de Cannabis sativa : la marihuana, que tiene altos niveles del psicoactivo tetrahidrocannabinol (THC); y el cáñamo, que tiene altos niveles de cannabinoides no psicoactivos y bajos niveles de THC. 11 Los dos principales compuestos de THC farmacológicamente activos son Δ8-THC y Δ9-THC. Los principales cannabinoides farmacológicamente activos no psicoactivos incluyen el cannabinol, el cannabidiol (CBD) y el cannabigerol ( Figura 1 ), así como otros no cannabinoides como los flavonoides, los terpenos y los ácidos grasos. 12 , 13
Los cannabinoides median sus efectos biológicos y terapéuticos a través de los receptores acoplados a proteína G, el receptor cannabinoide 1 (CB1R) y 2 (CB2R). 14 – 16 Las proteínas G actúan como adaptadores que vinculan los receptores acoplados a proteína G con la señalización intracelular y las proteínas reguladoras para activar o modular las vías de señalización. Otros receptores acoplados a proteína G, como GPR55 y GPR18, y los canales de potencial receptor transitorio (TRP), como TRPV2, TRPA1 y TRPM8, también están involucrados en la señalización de cannabinoides. 17 Altamente expresado en el sistema nervioso central, el CB1R se encuentra en niveles particularmente altos en el neocórtex, el hipocampo, los ganglios basales, el cerebelo y el tronco encefálico. 18 Por el contrario, se observan bajos niveles de expresión en el sistema nervioso periférico. El CB1R se une al principal ingrediente activo de la marihuana, el Δ9-THC, y media la mayoría de los efectos del THC en el sistema nervioso central. <sup>19</sup> El CB2R está presente en altos niveles en el sistema inmunitario y se asocia comúnmente con la regulación de la función inmunitaria. Además, el CB2R también se encuentra en el cerebro,<sup> 20</sup> donde se localiza principalmente en la microglía, los macrófagos residentes del sistema nervioso central. <sup>21</sup>
El hecho de que tanto los receptores CB1 como CB2 sean expresados por las células inmunitarias sugiere que los cannabinoides desempeñan un papel importante en la regulación del sistema inmunitario. Por ejemplo, se ha demostrado que los cannabinoides ejercen efectos antiinflamatorios en diversos modelos experimentales in vivo e in vitro . Además, varios estudios han demostrado que los cannabinoides regulan negativamente la producción de citocinas y quimiocinas y aumentan la de las células T reguladoras para suprimir las respuestas inflamatorias. 16 , 22
Efectos inmunomoduladores de los cannabinoides en la progresión de la enfermedad reumatoide: perspectivas de modelos preclínicos in vitro de regulación de citocinas
Varios estudios han reportado que el CBD reduce la formación de especies reactivas de oxígeno y óxido nítrico en diversas líneas celulares y modelos animales de inflamación. Además, el CBD bloquea la producción de TNFα, las citocinas proinflamatorias IL-1β, IL-2, IL-6 e IL-8, y el factor de transcripción factor nuclear (NF)-κB. 16 , 23 Además, el extracto con alto contenido de CBD exhibe la notable capacidad de disminuir la secreción de citocinas de las células T derivadas de donantes humanos. Asimismo, una cepa específica con alto contenido de CBD (CBD-X) demuestra una potente capacidad para suprimir eficazmente la tormenta de citocinas en un modelo murino. 24
Más evidencia de la capacidad de los cannabinoides para modular el sistema inmunológico proviene de estudios in vitro que mostraron que el Δ9-THC suprimió la respuesta celular de las células T helper 1 (Th1) y mejoró la secreción de citocinas asociadas a Th2. 25 Esta respuesta previene la activación de las vías de señalización inflamatoria, como el NF-κB, 26 la proteína quinasa activada por mitógenos y las vías de la quinasa Janus/transductor de señales y activador de la transcripción (JAK/STAT) en las células inmunes. 27
Otro estudio, realizado con células microgliales BV-2 activadas con lipopolisacáridos, reveló que tanto el THC como el CBD disminuyeron la activación de la señalización proinflamatoria al reducir la activación de la vía JAK/STAT. Además, el CBD suprimió la actividad de la vía NF-κB y potenció un ciclo de retroalimentación negativa antiinflamatoria a través de JAK/STAT3. 28
Un estudio reciente demostró que el CBD afecta directamente la expresión de microARN (miARN). Los resultados mostraron que el CBD disminuyó la expresión de miR146a, que actúa como regulador negativo de la inflamación, tanto en células en reposo como estimuladas con lipopolisacáridos, contribuyendo así a la capacidad del CBD para disminuir la regulación de las citocinas proinflamatorias. Además, el CBD aumentó la expresión de miR34a en las células de microglía BV-2, que desempeña diversas funciones en la supervivencia celular, como el ciclo celular, la apoptosis y la diferenciación. Estos resultados sugieren que las alteraciones en la expresión de miARN inducidas por el CBD forman parte del mecanismo por el cual el CBD suprime la función inmunitaria. 29
De forma similar, los cannabinoides sintéticos HU-210 y WIN55,212-2 previenen la degradación de la matriz inducida por IL-1α en condrocitos bovinos in vitro . Además, ambos cannabinoides inhibieron la degradación de proteoglicanos y colágeno inducida por IL-1α. Además, WIN55,212-2 inhibe la expresión de la óxido nítrico sintasa inducible y la COX-2, así como la activación de NF-κB.<sup> 30</sup> Este efecto se reprodujo utilizando el endocannabinoide anandamida y se potenció con los antagonistas de CB1 y CB2 AM281 y AM630. <sup>32</sup>
Perspectivas sobre la eficacia de los cannabinoides en el tratamiento de la progresión de la enfermedad reumatoide a partir de estudios en animales
Se han utilizado varios modelos animales de enfermedad reumatoide murina para investigar la posible eficacia antirreumática de los cannabinoides. Por ejemplo, Zurier et al. investigaron el impacto de la administración oral de ácido dimetilheptil-THC-11-oico (DMH-11C), un precursor no psicoactivo del THC, sobre la inflamación aguda y la poliartritis crónica en ratas Lewis macho. La inflamación aguda se indujo mediante la inyección subcutánea de IL-1β o TNFα en bolsas en el lomo de las ratas. En este modelo, la administración oral de DMH-11C redujo el número de leucocitos polimorfonucleares en las bolsas 6 horas después de la inducción de la inflamación. 32 Además, se indujo poliartritis crónica mediante la inyección intradérmica de adyuvante completo de Freund (2 ng de Mycobacterium butyricum en 0,1 mL de aceite mineral), que causa poliartritis en las cuatro patas. Esta poliartritis crónica inducida por adyuvantes se previno con DMH-11C. 32
De forma similar, el ácido tetrahidrocannabinólico y el THC alivian la artritis inducida por colágeno en ratones a través del receptor CB1, previniendo la infiltración de células inflamadas en la membrana sinovial, lo que reduce la hiperplasia y el daño del cartílago.<sup> 33 </sup> Además, la nocicepción puede disminuirse añadiendo THC y el endocannabinoide anandamida a ratas Sprague-Dawley macho tras la artritis inducida con adyuvante. El antagonista del receptor CB1, SR142716A, bloquea la antinocicepción desarrollada tras la administración de THC, pero no de anandamida, lo que sugiere que la señalización de la anandamida no se limita a la vía del receptor CB1. Sin embargo, los efectos del THC y la anandamida pueden ser inhibidos por la naloxona, lo que indica que inducen la liberación de opioides endógenos que median el efecto antinociceptivo. <sup>34 </sup>
La administración oral o intraperitoneal de CBD tiene un efecto antiartrítico en la artritis inducida por colágeno (AI) recidivante, tanto aguda como crónica. Con ambos métodos, las articulaciones se protegieron contra daños graves mediante la reducción de la producción de interferón γ y la liberación de TNFα en las células sinoviales de la rodilla.<sup> 35 </sup> Además, el THC indujo un efecto antinociceptivo mediado por CB1, pero no hiperalgésico, como se observó en un modelo de artritis inducida por adyuvante en ratas Sprague-Dawley.<sup> 36</sup>
El cannabinoide sintético no psicoactivo HU-320 posee potentes propiedades antiinflamatorias e inmunosupresoras. Estos efectos antiartríticos se observaron en un modelo murino de artritis inducida por colágeno. Además, la administración peritoneal diaria de HU-320 mejoró significativamente la CIA al proteger las articulaciones de las patas del daño patológico y suprimir la secreción sérica de TNFα de los macrófagos. 37
La administración transdérmica de CBD también reduce la inflamación y las conductas relacionadas con el dolor en un modelo de artritis inducida por adyuvante en ratas Sprague-Dawley. El gel de cannabidiol (CBD), aplicado durante cuatro días consecutivos en la articulación afectada, redujo significativamente la inflamación articular y los marcadores proinflamatorios. La latencia de retirada de la pata a la estimulación térmica nociva se recuperó casi al nivel basal, pero la conducta exploratoria no se alteró, lo que sugiere que el CBD tuvo un impacto limitado en la función cerebral. Estos resultados indican que la administración transdérmica de CBD puede ejercer efectos antiartríticos duraderos sin efectos secundarios neuronales (resumidos en la Tabla 1 ).
Tabla 1.
Ensayos preclínicos: estudios en animales.
| Referencia | Pregunta/Objetivo de la investigación | Inducción de artritis | Enfoque experimental | Resultado |
|---|---|---|---|---|
| Zurier y otros (1998) 32 | Evaluación de las actividades antiinflamatorias de un derivado sintético no psicoactivo del THC (DMH-11C) | Inflamación aguda: Inducción de inflamación aguda en bolsas aéreas dorsales con inyección de IL-1β y TNFα Poliartritis crónica : Inyección intradérmica de adyuvante completo de Freund (2 mg de Mycobacterium butyricum en 0,1 mL de aceite mineral) | Bolsas colocadas en el lomo de ratas Lewis macho, inflamación inducida con adyuvante intradérmico de Freund y artritis evaluada visualmente en las cuatro patas. Ratas Lewis asignadas a grupos y tratadas 3 días después del tratamiento con adyuvante:sin tratamientotratado con aceite de cártamotratados con 0,1 mg/kg de DMH-11C tres veces por semana durante 35 días | Administración oral de DMH-11C:Inflamación aguda: reducción de la acumulación de leucocitos polimorfonucleares llenos de bolsasPoliartritis crónica:- disminución de la gravedad de la artritis- evitó lesiones graves en el tejido articular- Las ratas con poliartritis crónica permanecieron activas sin pérdida de peso en comparación con las ratas de control con artritis.- desarrolló sólo sinovitis articular leve |
| Smith y otros (1998) 34 | Eficacia del Δ9-THC y la anandamida en el bloqueo de la nocicepción o la inflamación crónica | Inyección intradérmica de adyuvante completo de Freund (2 mg de Mycobacterium butyricum en 0,1 mL de aceite mineral) | Se inyectó adyuvante de Freund en la cara plantar de la pata de ratas Sprague-Dawley macho. | Administración intraperitoneal de Δ9-THC o anandamida:- efecto antinociceptivo del Δ9-THC y la anandamida- SR141716A (inhibidor de CB1) bloqueó el THC, pero no la nocicepción inducida por anandamida- no hay contribución potencial de la anandamida endógena en la artritis |
| Malfait y otros (2000) 35 | Propiedades antiartríticas del CBD no psicoactivo | Modelo murino de CIA en adyuvante completo de Freund | Inyección intradérmica en la base de la cola de ratones macho DBA/1 de CII emulsionado en adyuvante completo de Freund. Animales asignados a dos grupos:Administración intraperitoneal al inicio de los signos clínicos durante 10 días, en diferentes concentraciones 20 mg/kg ( n = 12), 10 mg/kg ( n = 17), 5 mg/kg ( n = 15), 2,5 mg/kg ( n = 9) disueltos en etanol:cremophor:salina (1:1:18); o vehículo solo ( n = 23)Administración oral al inicio de los signos clínicos durante 10 días, CBD disuelto en aceite de oliva a 10 mg/kg, 25 mg/kg y 50 mg/kg ( n = 6 por grupo); ratones de control alimentados con aceite de oliva ( n = 6). | Administración intraperitoneal u oral de CBD:- bloqueó la progresión de la AR- articulaciones protegidas de daños severos- disminución de la proliferación específica de CII de los ganglios linfáticos y de la producción de IFNγ ex vivo- disminución de la liberación de TNFα por las células sinoviales de la rodilla |
| Sumariwalla y otros (2004) 37 | Efectos antiinflamatorios e inmunosupresores del cannabinoide sintético HU-320 | Modelo murino de la CIA | HU-320 o control de vehículo (mezcla de cremophor-EL, etanol absoluto y PBS) administrado por vía peritoneal durante 10 días a ratones artríticos en diferentes dosis desde el día 1 de aparición de los signos clínicos a 0,5, 1 y 2 mg/kg de peso corporal. | Administración intraperitoneal diaria de HU-320- mejoró la artritis inducida por CII- articulaciones del pie protegidas de daños patológicos- respuestas policlonales y específicas de CII reguladas a la baja de los linfocitos murinos- niveles séricos suprimidos de TNFα |
| Cox y otros (2007) 36 | Efecto antinociceptivo del Δ9-THC | Artritis inducida por adyuvante de Freund en ratas Sprague-Dawley | Ratas Sprague-Dawley macho inyectadas intradérmicamente en la base de la cola con 0,1 ml de vehículo o adyuvante de Freund- ratas artríticas o no artríticas inyectadas intraperitonealmente con SR144528 (inhibidor de CB2), SR141716A (inhibidor de CB1) o vehículo (1:1:18, emulgente:etanol:solución salina)- ratas artríticas y no artríticas a las que se les inyectó intraperitonealmente Δ9-THC- Prueba de presión de la pata para evaluar la nocicepción. | Administración intraperitoneal de Δ9-THC:- efecto antinociceptivo- SR144528 atenuó el efecto antinociceptivo en ratas artríticas pero no en ratas no artríticas- SR141716A atenuó la antinocicepción en ratas artríticas y no artríticas |
| Hammell y otros (2016) 38 | Efectos antiinflamatorios y antinociceptivos de los geles de CBD | Artritis inducida por adyuvante completo de Freund en ratas Sprague-Dawley | Ratas Sprague-Dawley ( n = 54) asignadas a tres grupos y tratadas de la siguiente manera:no tratados ( n = 21)Una articulación de la rodilla inyectada con adyuvante completo de Freundvehículo o gel que contiene 1% o 10% de CBD administrado en el lomo de cada animal durante cuatro días consecutivos después del inicio de la artritis | Administración transdérmica de geles de CBD:- reducción significativa de la hinchazón de las articulaciones- reducción de la infiltración de células inmunes y engrosamiento de la membrana sinovial- la latencia de retirada de la pata se recuperó hasta cerca del valor inicial- reducción dependiente de la dosis de biomarcadores proinflamatorios- no alteró el comportamiento exploratorio |
| Palomares y otros (2020) 33 | Evaluación de las propiedades antiartríticas del Δ9-THCA-A | Modelo murino de la CIA | Ratones DBA/1 de 7 semanas de edad tratados dos veces con 100 μL de colágeno bovino tipo II, inyectado intradérmicamente en la base de la cola. Ratones asignados a grupos ( n = 9) y tratados con:Inhibidor de Δ9-THCA-A ± PPARγ,± antagonista del receptor CB1, ovehículoEvaluación del edema de la pata en una escala de 0 a 4 | La inyección intraperitoneal de Δ9-THCA-A previene:- artritis en ratones CIA- infiltración de células inflamatorias- hiperplasia sinovial- daño del cartílago- la expresión de genes inflamatorios y catabólicos en las articulaciones de la rodilla- actividad antiartrítica mediada por el receptor CB1 y la vía PPARγ |
CB1, cannabinoide 1; CBD, cannabidiol; CIA, artritis inducida por colágeno; CII, colágeno tipo II; ratones DBA/1, cepa de ratones, DMH-11C, ácido dimetilheptil-THC-11-oico; IFN, interferón; IL, interleucina; PBS, solución salina tamponada con fosfato; PPAR, receptor activado por el proliferador de peroxisomas; AR, artritis reumatoide; THC, tetrahidrocannabinol; THCA-A, ácido tetrahidrocannabinólico; TNF, factor de necrosis tumoral; Tx, tratamiento.
Efecto de los cannabinoides sobre la progresión de la enfermedad reumatoide en el líquido sinovial
En 2007, Richardson et al. demostraron que el sistema endocannabinoide desempeña un papel en las enfermedades reumatoides. Los autores examinaron el líquido sinovial de 32 pacientes con osteoartritis (OA) y 13 con AR tras una artroplastia total de rodilla. Se detectaron niveles de ARNm y proteína del endocannabinoide 2-araquidonil glicerol, así como de los receptores cannabinoides CB1 y CB2, en el líquido sinovial de pacientes con OA y AR, pero no en donantes sanos. Además, la estimulación del receptor se correlacionó con la activación de la quinasa regulada por señales extracelulares (ERK1/2), bloqueada por el antagonista de CB1 SR141716A. Estos resultados sugieren la participación del sistema endocannabinoide en el desarrollo de enfermedades reumatoides. 39
En la AR, las citocinas proinflamatorias y las metaloproteinasas de matriz (MMP) se liberan en el tejido sinovial, donde promueven la degradación del cartílago y la erosión ósea, lo que lleva a deformidades óseas. 40 , 41 Experimentos ex vivo realizados por Johnson et al. mostraron que el ácido ajulémico, un ácido cannabinoide no psicoactivo, suprimió la producción de MMP de células sinoviales similares a fibroblastos tomadas de las articulaciones afectadas de pacientes que sufrían de OA, o AR, o artritis psoriásica. 42 Además, los cannabinoides sintéticos CP55,940 y WIN55,212-2 redujeron significativamente la secreción de las citocinas proinflamatorias IL-6 e IL-8 de fibroblastos sinoviales estimulados con IL-1β extraídos de pacientes con AR con afectación de la articulación de la rodilla (OA) y cirugía de reemplazo de articulación de rodilla. Este estudio mostró que este efecto no estaba mediado por CB1 y CB2, 43 lo que sugiere la participación de otros receptores relacionados con el cannabis. Otro grupo confirmó los resultados de WIN55,212-2 y demostró además que el tratamiento redujo la liberación de MMP3 de los fibroblastos sinoviales de pacientes con AR y OA. Este efecto fue mediado por la subfamilia V1 (TRPV1) y la subfamilia A1 (TRPA1) del canal catiónico de potencial receptor transitorio (TRP), no por CB1 ni CB2. Un estudio de seguimiento demostró que el CBD también reduce la secreción de IL-6, IL-8 y MMP3 de los fibroblastos sinoviales de pacientes con AR. Además, el CBD aumentó los niveles intracelulares de calcio y redujo la viabilidad celular a través de TRPA1, pero no de TRPV1. Asimismo, el bloqueo del poro de transición de la permeabilidad mitocondrial mediante ciclosporina A previno los efectos del CBD sobre la viabilidad celular y la producción de IL-8. Además, los efectos del CBD se potenciaron al añadir TNFα, lo que sugiere que el CBD actúa preferentemente en un entorno proinflamatorio y que podría mejorar la artritis al actuar sobre los fibroblastos sinoviales proinflamatorios.
Ese mismo año, otro grupo demostró en un estudio aleatorizado, controlado con placebo y doble ciego de 4 semanas de duración, realizado en un modelo canino espontáneo de OA, que el CBD, administrado como CBD puro o encapsulado en liposomas, podía inhibir la producción de las citocinas proinflamatorias IL-6 y TNFα, a la vez que aumentaba la producción de la citocina antiinflamatoria IL-10. Además, el dolor se redujo significativamente, lo que condujo a un aumento de la movilidad dependiente de la dosis. Curiosamente, el CBD puro requirió una dosis mayor (50 mg/día) para obtener el mismo efecto que 20 mg/día de CBD liposomal. Estos resultados apuntan al potencial terapéutico seguro de los cannabinoides para aliviar el dolor. 46
De acuerdo con estos estudios, publicamos resultados similares utilizando extractos con alto contenido de THC o CBD en modelos murinos de inflamación pulmonar sistémica o local. El CBD, pero no el THC, atenuó los niveles de las citocinas proinflamatorias IL-1β y TNFα, junto con un aumento concomitante de la citocina antiinflamatoria IL-10. Además, observamos que el extracto con alto contenido de CBD disminuyó la migración de neutrófilos inflamatorios al foco de infección, lo que resultó en una reducción de los niveles de las citocinas proinflamatorias IL-1β, MCP-1, IL-6 y TNFα en el pulmón inflamado. Sin embargo, de los tres extractos con alto contenido de CBD analizados, solo uno mostró estos efectos inhibidores, lo que explica por qué los estudios sobre la influencia de los cannabinoides muestran resultados ambiguos. Se necesita más investigación sobre este fenómeno, incluyendo estudios clínicos en humanos con extractos que mostraron efectos terapéuticos en estudios previos con animales. 24
En contraste con las propiedades antiartríticas observadas en estudios animales y ex vivo , Kotschenreuther et al. observaron un aumento en la diferenciación de células T auxiliares Th17 proinflamatorias aisladas de la sangre periférica de pacientes con artritis reumatoide o psoriásica o lupus eritematoso sistémico tratados con aceite de CBD o el cannabinoide endógeno anandamida durante 4 a 8 semanas. Los autores argumentan que la variabilidad de los receptores de CBD entre modelos animales y humanos podría contribuir a las discrepancias. Además, muchos estudios animales utilizan inhibidores de CB1 o CB2 para investigar la función de los cannabinoides. Por lo tanto, los autores sugieren usar cannabinoides en pacientes con AR con precaución (resumido en la Tabla 2 ). 47
Tabla 2.
Estudios con líquido sinovial.
| Referencia | Objetivo de la investigación | Diseño del estudio | Intervención | Participantes, n (F/M) | Solicitud de cannabis | Duración de TX | Eficacia |
|---|---|---|---|---|---|---|---|
| Johnson y otros (2007) 42 | Influencia de AjA en la producción de MMP en FLS humanos y papel de PPAR□ | Estudio ex vivo sobre FLS en pacientes con AR | AjA | Líquido sinovial extraído de las articulaciones de pacientes con AR, OA o artritis psoriásica | Ácido AjA en DMSO | 60 min Tx AjA seguido de estimulación con 10 ng/mL rhIL-1α rhTNFα durante 18-24 horas | - AjA suprimió la producción de MMP de FLS, independientemente de PPAR□- AjA suprimió la secreción de MMP3 en MEF PPAR +/- y PPAR -/- estimulados por TNFα e IL-1α |
| Richardson y otros (2008) 39 | Determinar si los elementos de señalización cannabinoide están presentes en la sinovia de pacientes con AR o OA | Líquido sinovial ex vivo | Se cuantificaron los niveles de endocannabinoides en biopsias sinoviales. | Pacientes con OA ( n = 32) o AR ( n = 13) sometidos a artroplastia de rodilla y voluntarios sanos | No | No | - Las proteínas CB1 y CB2 y el ARN estaban presentes en la sinovial de pacientes con OA y AR.- La estimulación del receptor cannabinoide activa de forma dependiente del tiempo MAPK/ERK1/2, que es bloqueada por SR141716A (antagonista CB1)- Se encontraron AEA y 2-AG en la membrana sinovial de pacientes con artrosis y artritis reumatoide, pero no en voluntarios sanos.- Hidrolasa de amida de ácidos grasos activa en la sinovial de pacientes con artrosis y artritis reumatoide. |
| Selvi y otros (2008) 43 | Propiedades antiinflamatorias de los cannabinoides sintéticos CP55,940 y WIN | Estudio ex vivo sobre FLS en pacientes con AR | Cannabinoides sintéticos CP55,940 y WIN | Líquido sinovial de 5 pacientes con AR y afectación de la articulación de la rodilla (cirugía de reemplazo de articulación de rodilla por OA) | FLS tratado con CP55,940 y WIN durante 3 horas Medición de citocinas proinflamatorias antes y después del Tx | 3 horas 1 hora de pre-tratamiento con antagonista del receptor de cannabinoides, 1 hora de preincubación o con 0,1 ng/mL de IL-1α | - Ambos cannabinoides indujeron una reducción potente y significativa de la secreción de IL-6 e IL-8 de FLS estimuladas con IL-1α.- Independiente de acciones antagónicas |
| Lowin y otros (2016) 44 | Propiedades antiartríticas del cannabinoide sintético WIN | Estudio ex vivo de pacientes con RASF | CBD | n = 21/7 AR de larga duración Edad media 61,1 ± 10,7 | CBD en DMSO | Hasta 72 min | - Reducción/inhibición dependiente de la concentración de la secreción de IL-6, IL-8 y MMP3- Los efectos de alta concentración de WIN dependen en parte del contenido de FCS del medio- WIN influye en la adhesión a la fibronectina (concentraciones bajas <2 μM estimulan la adhesión; concentraciones más altas >2 μM disminuyen la adhesión)- Concentraciones de WIN >1 μM detuvieron la proliferación celular- WIN en altas concentraciones >2 μM cambió las formas de las células de extendidas con fibropodios a formas de bordes afilados con un núcleo condensado y vacuolización extensa.- Las actividades de WIN fueron independientes de CB1 o CB2 pero atenuadas por los inhibidores de TRPV1 o TRPA1 |
| Lowin y otros (2020) 45 | Evaluación de las propiedades antiartríticas del CBD | Investigación de RASF ex vivo en pacientes con AR | 32 mujeres y 8 hombres con AR de larga duración que cumplen los criterios ACR, edad media 66,9 ± 8,2 años | - El CBD redujo la viabilidad celular y la proliferación de RASF- El CBD aumentó el Ca 2+ intracelular , efectos potenciados por el TNFα- La movilización de Ca 2+ y la captación de PoPo3 dependían en parte de la activación de TRPA1- Los objetivos mitocondriales median los efectos del CBD | |||
| Kotschenreuther et al. (2021) 47 | Análisis del impacto de los cannabinoides en la diferenciación Th17 en pacientes con AR | Investigación de la diferenciación de células T auxiliares ex vivo en células de sangre periférica de pacientes con AR | Donantes sanos | Puntos de AR | - El CBD y la AEA aumentaron la diferenciación Th17 en las células T CD4 + de pacientes con AR, pero no en los donantes sanos.- La adición de citocinas TGFβ, IL-1α, IL-6 e IL-23 aumentó las propiedades inductoras de Th17 del CBD.- El tratamiento con aceite de CBD durante 4 a 8 semanas aumentó la expansión de células Th17- Puntuación de actividad de la enfermedad: recuento de 28 articulaciones. La proteína C reactiva aumentó durante el tratamiento con CBD.- Efecto inmunomodulador del CBD no mediado por CB1, CB2 o GPR55- El CBD aumentó la expresión de sgk1 y ahr y disminuyó la expresión de csf2- Resultados contrarios a los resultados en ratones donde el CBD mejoró la AR |
2-AG, 2-araquidonil glicerol; ACR, Colegio Americano de Reumatología; AEA, N-araquidonoiletanolamina; AjA, ácido ajulémico; CB1/CB2, cannabinoide 1/cannabinoide 2; CBD, cannabidiol; DMSO, dimetilsulfóxido; F, hembras; FCS, suero bovino fetal; FLS, células sinoviales similares a fibroblastos; GPR55, receptor 55 acoplado a proteína G; M, machos; MAPK/ERK1/2, proteína quinasa activada por mitógeno/quinasa regulada extracelular; MEF, fibroblastos embrionarios de ratón; MMP, metaloproteinasa de matriz; OA, osteoartritis; PPAR, receptor activado por el proliferador de peroxisomas; pts, pacientes; AR, artritis reumatoide; RASF, fibroblastos sinoviales de artritis reumatoide; rh, humano recombinante; ARN, ácido ribonucleico; TNF, factor de necrosis tumoral; Th17, T helper 17; TRPA1, canal catiónico de potencial transitorio del receptor subfamilia A1; TRPV1, canal catiónico de potencial transitorio del receptor subfamilia V1; Tx, tratamiento; WIN, WIN55,212-2.
Efectos del cannabis medicinal sobre el dolor reumatoide
La enfermedad reumatoide se caracteriza por dolor crónico, que disminuye significativamente la calidad de vida de quienes la padecen. Actualmente, no se dispone de tratamientos eficaces ni de un manejo adecuado del dolor para las enfermedades reumatoides. Por lo tanto, se necesitan terapias alternativas para el manejo del dolor. El impacto de los extractos medicinales de cannabis en el dolor crónico se ha evaluado en varios ensayos clínicos aleatorizados, doble ciego y controlados con placebo. Por ejemplo, Notcutt et al. compararon tres extractos medicinales a base de cannabis que contenían THC, CBD o una mezcla, en 34 pacientes durante 12 semanas. Los extractos a base de THC fueron más efectivos en el control del dolor cuando se usaron como aerosol sublingual, con solo efectos secundarios leves. 48 Otro grupo probó nabiximols (Sativex®), que comprende una combinación uniforme de CBD y THC (cada 100 microlitros contiene 2,7 mg de THC y 2,5 mg de CBD) en 58 pacientes con AR. Durante cinco semanas, Sativex® se administró como un aerosol oromucosal por la noche. Se evaluó a los pacientes en cuanto a dolor de movimiento y en reposo, rigidez matutina y calidad del sueño mediante el Cuestionario de Dolor de McGill (forma corta) y la medida DAS28 de actividad de la enfermedad. Las mejoras estadísticamente significativas con Sativex® aliviaron el dolor de movimiento y en reposo, así como la calidad del sueño, pero no la rigidez matutina. Además, no se observaron signos de abstinencia ni efectos secundarios graves. 49
Otros estudios evaluaron los efectos analgésicos del cannabis en pacientes con dolor neuropático administrado mediante vaporizador. En un estudio cruzado, doble ciego y controlado con placebo, 35 pacientes con dolor neuropático central y periférico recibieron cannabis a base de THC en dosis medias (3,53 %) o bajas (1,29 %), o placebo. Según la puntuación de intensidad del dolor en una escala analógica visual, la respuesta analgésica mostró un efecto similar a la eficacia obtenida con analgésicos convencionales. Solo se midieron efectos psicoactivos leves, reversibles y de duración limitada. <sup>50</sup> Otro ensayo cruzado reciente, aleatorizado y controlado con placebo, de cuatro vías, investigó los efectos analgésicos del cannabis de grado farmacéutico inhalado. Se probaron cuatro variantes diferentes de cannabis con contenido conocido de THC y CBD en un pequeño grupo de 20 pacientes con fibromialgia. Las variedades con alto contenido de THC redujeron significativamente el umbral del dolor a la presión en comparación con el placebo después de una sola inhalación. Curiosamente, este efecto se vio disminuido al inhalar CBD, lo que sugiere una interacción farmacodinámica antagónica entre el THC y el CBD. <sup>51</sup>
Una revisión reciente de ensayos clínicos sobre la reducción del dolor con cannabis mostró que los medicamentos a base de cannabis fueron más efectivos como terapias adyuvantes en la esclerosis múltiple refractaria y en el manejo del dolor reumatoide crónico. 52 Otro grupo en Nueva Zelanda llegó a una conclusión similar después de revisar la literatura sobre el uso de productos medicinales a base de cannabis para la artritis. Observaron que, si bien los estudios en animales han demostrado un efecto potencial de los productos de cannabis en el dolor de la artritis, un estudio aleatorizado controlado con placebo de Sativex® no mostró una ventaja sobre los tratamientos farmacológicos convencionales estándar. Por lo tanto, concluyeron que, debido a la falta de evidencia clara, no se debe recomendar a los médicos que receten medicamentos a base de cannabis para la artritis. 53 Se plantea la hipótesis de que la actividad analgésica del THC en el dolor crónico involucra la función de dos áreas principales de modulación cognitivo-emocional y sus conexiones con las áreas somatosensoriales (resumidas en la Tabla 3 ). 54
Tabla 3.
Ensayos clínicos sobre el dolor.
| Referencia | Objetivo de la investigación | Diseño del estudio | Intervención | Participantes n (F/M) | Solicitud de cannabis | Duración de la transacción | Eficacia |
|---|---|---|---|---|---|---|---|
| Notcutt y otros (2004) 48 | Comparación de tres variantes de CBME | Ensayo cruzado, aleatorizado, doble ciego y controlado con placebo | THC, CBD, THC+CBD, placebo | n = 34 | Spray sublingual | 12 semanas | Se ha demostrado la máxima eficacia del cannabis basado en THC en la regulación del dolor con efectos secundarios muy leves. |
| Blake y otros (2006) 49 | Eficacia del CBME Sativex® sobre el dolor y la rigidez matutina | Ensayo aleatorizado, doble ciego, de grupos paralelos | Cuestionario de McGill sobre CBME basado en THC de Sativex® | n = 58: 31 CBME 27 placebo | aerosol oromucosal | 5 semanas | - Mejora del dolor con el movimiento y el reposo, pero sin cambios en la rigidez matutina.- Sin efectos secundarios ni síntomas de abstinencia. |
| Wilsey y otros (2013) 50 | Efectos a corto plazo del CBME para el dolor neuropático | Estudio aleatorizado, doble ciego, controlado con placebo y cruzado | Basado en THC Dosis media (3,53%); dosis baja (1,29%) Placebo | n = 35 | Vaporizador 3–6 inhalaciones | 300 minutos | - El cannabis tenía efectos similares a los analgésicos convencionales.- Efectos psicoactivos leves reversibles de duración limitada. |
| van de Donk y otros (2019) 51 | Comparación de cuatro variantes de cannabis con contenido conocido de THC y CBD | Estudio cruzado de 4 vías, aleatorizado y controlado con placebo | Bedrocan * (22,4 mg de THC, <1 mg de CBD); Bediol * (13,4 mg de THC, 17,8 mg de CBD); Bedrolite * (18,4 mg de CBD, <1 mg de THC) | n = 20 pacientes con fibromialgia | Vaporizador Una sola inhalación | 3 horas | - Ningún efecto de los tratamientos sobre las respuestas dolorosas espontáneas o eléctricas, excepto una reducción del 30 % del dolor en pacientes que recibieron Bediol- Las variedades que contienen THC lograron una reducción significativa del dolor por presión.- Aumento de las concentraciones plasmáticas de THC en las variedades que contienen CBD, pero se disminuyeron los efectos analgésicos inducidos por el THC. |
| Haleem y Wright (2020) 52 | Efecto del cannabis medicinal y los CBME sobre el dolor | Revisión del alcance | Cannabis herbal y CBME | 34 estudios (30 ECA, 4 no ECA) | Diverso | Diverso | - Se obtuvieron resultados más prometedores de los no RCT que de los RCT- Resultados más prometedores obtenidos para el tratamiento del dolor como terapia adyuvante en la esclerosis múltiple refractaria y el dolor reumatoide |
*
Fabricado por Bedrocan International BV, Veendam, Países Bajos.
CBD, cannabidiol; CBME, extracto medicinal a base de cannabis; RCT(s), ensayo(s) controlado(s) aleatorio(s); THC, tetrahidrocannabinol.
Estudios retrospectivos sobre el uso del cannabis medicinal
Estudios retrospectivos, en forma de encuestas transversales exploratorias, sobre el consumo recreativo de cannabis en pacientes reumatológicos diagnosticados antes y después de la legalización del cannabis en Canadá revelaron que, tras la legalización, el porcentaje de consumidores de cannabis se triplicó, pasando del 4,3 % al 12,6 %. La mitad de los consumidores padecía artrosis y lo utilizaba para aliviar el dolor. Por lo general, los consumidores de cannabis medicinal eran consumidores recreativos anteriores o actuales, o con antecedentes de abuso de drogas, más jóvenes que los no consumidores, hombres y de bajo nivel socioeconómico. Se utilizaron diferentes vías de administración, desde fumar, vaporizar y administrar por vía oral, y los consumidores desconocían el contenido del producto. Solo el 20 % del cannabis se adquirió por vía medicinal, y solo un tercio informó a su reumatólogo sobre su consumo de marihuana. Más del 50 % interrumpió el consumo de cannabis por falta de efecto y el 28 % por efectos adversos . 55–57
Resultados similares se obtuvieron en una encuesta nacional retrospectiva del Reino Unido, realizada entre 1998 y 2002. Un cuestionario autoadministrado sobre el consumo de cannabis, completado por 2969 participantes, reveló que el cannabis medicinal se utilizaba para el dolor crónico (25%), la esclerosis múltiple y la depresión (22% cada una), la artritis (26%) y la neuropatía (19%). El consumo de cannabis medicinal se asoció con una edad más joven, el sexo masculino y el consumo recreativo previo. La frecuencia de consumo de cannabis fue diaria (35%), de 3 a 5 días por semana (23%), de 1 a 2 días por semana (15%) y menos frecuente (27%). La principal vía de administración fue fumar (82%), seguida de comer (43%), beber té (28%) y otras vías (14%). Se observó una mejoría de los síntomas en el 68% de los usuarios y una ligera mejoría en el 27%. Los usuarios también afirmaron que el cannabis funcionaba mejor (45%) o algo mejor (28%) en comparación con otros medicamentos. Los efectos secundarios, en comparación con otros medicamentos, fueron peores (6%), algo peores (23%) e iguales (54%). Tras suspender el consumo de cannabis, el 77% de los usuarios afirmó que sus síntomas reaparecieron o empeoraron. Los autores concluyeron que esta encuesta ofreció una visión general del consumo de cannabis medicinal y respaldó el desarrollo de medicamentos seguros y eficaces a base de cannabis. 58
Un metaanálisis reciente llegó a una conclusión similar. De 29.000 pacientes, 10.873 eran consumidores de cannabis (40,4%), de los cuales el 15,3% eran consumidores actuales. Un mayor porcentaje de pacientes con fibromialgia (68,2%), en comparación con el 26,0% de los pacientes con AR o lupus eritematoso, consumían cannabis. Los consumidores de cannabis eran más jóvenes (58,4% frente al 63,6%), fumadores (2,91% frente al 1,84%), desempleados (2,4% frente al 1,31%) y con mayor intensidad del dolor (5,0% frente al 4,1%) en comparación con los no consumidores. El consumo de cannabis ayudó a reducir la intensidad del dolor en una escala EVA de 8,2 a 5,6. El metaanálisis concluyó que alrededor del 20% de los pacientes con enfermedades reumatoides que consumen activamente cannabis informan una mejoría del dolor (resumido en la Tabla 4 ). 59
Tabla 4.
Estudios retrospectivos sobre el uso de cannabis medicinal.
| Referencia | Pregunta/Objetivo de la investigación | Diseño del estudio | Participantes/Intervención | Resultado | |
|---|---|---|---|---|---|
| Grupo de control | Grupo de prueba | ||||
| Ware y otros (2005) 58 | Prevalencia de consumidores de cannabis medicinal en el Reino Unido | Encuesta retrospectiva a nivel nacional | 2.969 participantes | - MMJ utilizado para: dolor crónico (25%); esclerosis múltiple (22%); depresión (22%); artritis (26%); neuropatía (19%)- El consumo de cannabis se asocia con una edad más joven, sexo masculino y uso recreativo previo.- Frecuencia de consumo de cannabis: diario (35%); 3–5 días/semana (23%); 1–2 días/semana (15%); menos frecuente (27%)- Vías de administración: fumar (82%); comer (43%); beber té (28%); otras vías (15%)- Mejora de los síntomas: mejora (68%); mejora leve (27%); el cannabis funcionó mejor que otros medicamentos (45%); el cannabis funcionó algo mejor (28%)- Efectos secundarios del cannabis en comparación con otros medicamentos (6/872 peores; 23/872 algo peores; 4/782 aproximadamente iguales)- Efectos secundarios de otros medicamentos en comparación con el cannabis (30% peor; 34% mucho peor; 26% imposible de determinar) | |
| Ste-Marie y otros (2016) 55 | Prevalencia de consumidores de marihuana entre pacientes de reumatología con diagnóstico confirmado en Canadá | Estudio exploratorio y encuesta transversal con cuestionarios codificados: (1) diagnóstico ingresado por el médico; (2) consumo de marihuana ingresado por el paciente. | No usuarios de MMJ | Usuarios de MMJ | - El 4,3% eran antiguos usuarios de MMJ, de los cuales el 2,8% son usuarios actuales.- No hay diferencias en la prevalencia de la enfermedad entre los grupos- Los usuarios de MMJ tienen más probabilidades de estar en tratamiento con opioides- Los usuarios actuales de MMJ eran más jóvenes (52,8 frente a 62,8 años), estaban desempleados o eran discapacitados (46,4% frente a 7,9%) y tendían a ser hombres.- Los usuarios de MMJ informaron puntuaciones más altas de PtGA y dolor que los no usuarios (6,3 % frente a 4,8 %)- >80% de los usuarios de MMJ informaron haber consumido marihuana recreativa previamente- El 80% de los usuarios de MMJ estaban satisfechos con los efectos en el alivio del dolor, la disminución de la ansiedad, las náuseas y la mejora del sueño.- La PGA evaluada por el médico no difirió entre los usuarios de MMJ y los no usuarios.- Los usuarios de MMJ tuvieron una enfermedad más grave que los no usuarios, según lo medido por las puntuaciones PGA y PtGA (evaluadas por el paciente) (≥6) |
| Jennings y otros (2019) 57 | Cambio en el consumo de marihuana autoreportado en pacientes después de la legalización del cannabis | Estudio de cohorte retrospectivo | n = 500 antes de la legalización (pacientes que se habían sometido a una artroplastia) | n = 500 después de la legalización (pacientes que se sometieron a una artroplastia) | - El consumo autodeclarado aumentó del 1% al 11% después de la legalización.- Usuarios tras la legalización: 46% uso recreativo, 26% uso medicinal, 27% sin motivo, 2% uso recreativo y medicinal.- Los usuarios eran más jóvenes (diferencia de 10 años entre usuarios y no usuarios), sexo masculino (61%), fumadores actuales (37%), antecedentes de abuso de sustancias (14%), nivel socioeconómico bajo |
| Fitzcharles y otros (2020) 60 | Prevalencia de consumidores de marihuana entre pacientes de reumatología con diagnóstico confirmado en Canadá después de la legalización de la marihuana | Estudio observacional, dos cuestionarios: (1) llenado por el médico sobre el diagnóstico, (2) llenado por el paciente sobre el consumo de marihuana | No usuarios de MMJ | Usuarios de MMJ | - <12,6% de los pacientes de reumatología eran usuarios actuales de MMJ- El 28,3% eran usuarios de cannabis recreativo, de los cuales el 4,9% eran usuarios actuales (de estos, el 44,9% utilizaba actualmente MMJ)- Los usuarios actuales de MMJ eran más jóvenes (61,2 frente a 64,9 años), desempleados o discapacitados (16,7% frente a 5,9%)- >80% de los usuarios de MMJ informaron haber obtenido cannabis a través de una vía no medicinal (contacto personal, tienda, mercado negro)- El 69% de los pacientes informó alivio del dolor, el 12% mejoró el sueño, el 15% mejoró la fatiga y el 8% mejoró el estado de ánimo.- Puntuaciones PGA y PtGA para el alivio de los síntomas: 6,7 ± 2,5- Efectos adversos reportados por 61,5% (35% efectos cognitivos, incluyendo somnolencia, fatiga y falta de motivación; 26% ansiedad; 20% falta de motivación; 26% más de un efecto secundario) |
| Guillouard y otros (2021) 59 | Prevalencia del consumo de cannabis | Metaanálisis | n = 18.127 no usuarios | n = 10.873 consumidores de cannabis | De los 29.000 participantes incluidos, el 40% había consumido cannabis, de los cuales el 15,3% eran consumidores actuales. Uso de cannabis para:- Fibromialgia (68,2%)- AR o lupus eritematoso (26%)- El consumo de cannabis se asocia a una edad más joven, a fumadores de cigarrillos, a un nivel socioeconómico bajo y a una mayor intensidad del dolor.- El cannabis redujo la intensidad del dolor de 8,2 a 5,6 (EVA)- El 20% de los pacientes con enfermedades reumatoides consumieron cannabis y reportaron mejoría del dolor. |
MMJ, marihuana/cannabis medicinal; PGA, evaluación global del médico de la actividad de la enfermedad; PtGA, evaluación global del paciente de la actividad de la enfermedad; AR, artritis reumatoide; VAS, escala analógica visual.
Efectos adversos del cannabis
Aunque los efectos adversos de los extractos medicinales a base de cannabis se han descrito principalmente como leves y reversibles, algunos estudios han demostrado que los pacientes que consumen cannabis natural suspendieron su consumo debido a los efectos secundarios. Estos efectos adversos afectan principalmente a las habilidades psicomotoras y cognitivas, así como al sistema cardiovascular. 61 Los efectos psicomotores, como el aumento del tiempo de reacción, la atención selectiva alterada, la memoria a corto plazo y el control motor, se ven afectados inmediatamente por el cannabis y pueden persistir hasta cinco horas. 62 El impacto en la cognición se observa como una disminución de la capacidad de aprendizaje y la retención de información nueva, y puede durar hasta varios días. Además, la capacidad de conducir y el estado de alerta se ven gravemente afectados hasta 24 horas después del consumo de cannabis medicinal, 63 por lo que no sorprende que entre el 0,5 % y el 7,6 % de los conductores con lesiones graves fueran consumidores de cannabis. 64
Los eventos cardiovasculares graves relacionados con el consumo agudo de cannabis medicinal incluyen taquicardia, hipotensión, 65 y un mayor riesgo de infarto de miocardio en personas con angina de pecho.66 En un informe de la Red Francesa de Adicción, se describieron 35 eventos vasculares entre 2006 y 2010 , de los cuales el 26 % condujo a muerte cardiovascular.67
El consumo regular de cannabis, especialmente en adolescentes, podría provocar un deterioro dependiente de la dosis en el rendimiento cognitivo y la memoria a corto plazo, así como trastornos del estado de ánimo e incluso psicosis. 68
La prevalencia del consumo de cannabis medicinal aumenta constantemente en los historiales médicos de las personas que padecen dolor crónico. Esta tendencia global se ejemplifica, en parte, por el hecho de que el 40 % de los pacientes con cáncer recurren al cannabis para aliviar el dolor en regiones donde el cannabis medicinal es legalmente accesible, como países como Canadá, Alemania e Israel. 56 En consecuencia, los pacientes con cáncer pueden tener un mayor riesgo de experimentar efectos secundarios y desarrollar dependencia al cannabis.
Con respecto al desarrollo del cáncer, el cannabis suele percibirse como relativamente benigno, sobre todo en comparación con el tabaco. Sin embargo, investigaciones recientes han revelado que fumar cannabis puede provocar la producción de carcinógenos, como nitrosaminas e hidrocarburos aromáticos policíclicos, similares a los presentes en el humo del cigarrillo. 69 Además, el humo del cannabis contiene agentes inmunosupresores y una mezcla de sustancias potencialmente mutagénicas. 691 A pesar de estos descubrimientos, el cannabis, a diferencia del tabaco y el alcohol, no se ha establecido de forma concluyente como un factor de riesgo de cáncer. No obstante, estudios básicos de laboratorio han demostrado el potencial mutagénico del cannabis in vitro . 70
Ensayos clínicos en curso
Solo se encontró un ensayo clínico intervencionista en curso en la base de datos de la Biblioteca Nacional de Medicina ( ClinicalTrials.gov ), realizado por Elizabeth Aston de la Universidad Brown, Providence, Rhode Island, Estados Unidos. Este estudio cruzado, doble ciego y controlado con placebo está reclutando actualmente a 76 pacientes con artritis psoriásica y reumatoide para investigar el impacto del cannabis en la inflamación y el dolor. Se administrará cannabis con un contenido medio de THC o CBD mediante vaporización en dos sesiones experimentales, y el dolor se evaluará mediante autoinformes. Este ensayo clínico de fase 2 será el primero a nivel mundial en examinar el impacto de dos cannabinoides diferentes en un ensayo clínico entre pacientes con artritis psoriásica o AR y podría ayudar a desarrollar un estándar de atención para el uso de cannabinoides para el tratamiento de la artritis. 71
Además, un estudio observacional con 500 participantes diagnosticados con AR, espondiloartritis o artritis psoriásica examina la prevalencia del consumo de cannabis y busca refinar las características del consumo y los factores de riesgo. Este estudio espera mejorar aún más el manejo general de los pacientes con enfermedades reumáticas inflamatorias. 72
CONCLUSIÓN
Estudios preclínicos in vitro e in vivo muestran resultados prometedores respecto a las propiedades antiartríticas de los cannabinoides, tanto psicoactivos como no psicoactivos. Estas propiedades antiartríticas están mediadas por los efectos antiinflamatorios de los cannabinoides, que incluyen la inhibición de la producción de citocinas proinflamatorias y óxido nítrico, así como de la proliferación de fibroblastos sinoviales ( Figura 2 ).
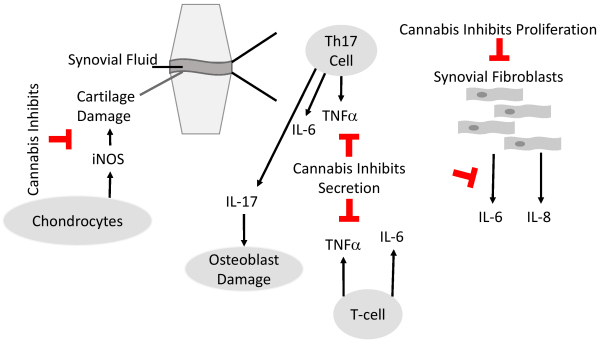
Estos efectos se observaron principalmente en estudios preclínicos in vitro y ex vivo , así como en modelos animales, dado que los estudios clínicos son escasos. Un estudio clínico observó un aumento de las células auxiliares Th17 proinflamatorias tras el consumo de aceite de CBD en pacientes con AR. Se sugirió que la variabilidad de los receptores cannabinoides podría contribuir a esta discrepancia entre los resultados preclínicos en animales y humanos. 47 Además, diferentes cepas de cannabis pueden producir diferentes resultados. 73 Por lo tanto, los estudios clínicos que utilizan cepas de cannabis bien definidas podrán determinar mejor el resultado y definir las propiedades antiartríticas de las cepas de cannabis administradas.
Las investigaciones futuras deberían centrarse en determinar las propiedades antiinflamatorias exactas de los componentes del cannabis en cepas específicas para proporcionar una terapia dirigida con mayor precisión a los pacientes adecuados. Este es un aspecto de la investigación sobre el cannabis que nuestro centro de investigación está desarrollando.
Expresiones de gratitud
Queremos agradecer a Raphael Pharmaceutical Inc. por apoyar este estudio.
Abreviaturas
CB1R
receptor cannabinoide 1CB2R
receptor cannabinoide 2CBD
cannabidiolDMH-11C
ácido dimetilheptil-THC-11-oicoFAME(s)
fármacos antirreumáticos modificadores de la enfermedadIllinois
interleucinaJAK/STAT
Janus quinasa/transductor de señales y activador de la transcripciónMMP(s)
metaloproteinasa(s) de matrizARN
ácido ribonucleicomiARN
microARNNF
factor nuclearOA
osteoartritisREAL ACADEMIA DE BELLAS ARTES
artritis reumatoideTh1
T ayudante 1THC
tetrahidrocannabinolTNF
factor de necrosis tumoralTRP
potencial de receptor transitorio
Notas al pie
Conflicto de intereses: No se informó de ningún potencial conflicto de intereses relevante para este artículo.
Financiación: Este trabajo fue apoyado por la subvención RAMBAM MED-TECH Milestone y la subvención de investigación sobre cannabinoides e inflamación de Raphael Pharmaceutical Inc.
REFERENCIAS
- 1.Smolen JS, Aletaha D, McInnes IB. Artritis reumatoide. Lancet. 2016;388:2023–38. doi: 10.1016/S0140-6736(16)30173-8. [ DOI ] [ PubMed ] [ Google Académico ]
- 2.Balbir-Gurman A, Guralnik L, Yigla M, Braun-Moscovici Y, Hardak E. Aspectos de imagenología de la enfermedad pulmonar intersticial en pacientes con artritis reumatoide: revisión bibliográfica. Autoimmun Rev. 2018;17:87–93. doi: 10.1016/j.autrev.2017.09.013. [ DOI ] [ PubMed ] [ Google Académico ]
- 3.Cross M, Smith E, Hoy D, et al. La carga global de artritis reumatoide: estimaciones del estudio Carga Global de Enfermedad 2010. Ann Rheum Dis. 2014;73:1316–22. doi: 10.1136/annrheumdis-2013-204627. [ DOI ] [ PubMed ] [ Google Académico ]
- 4.Nawaz H, Ali A, Rehman T, Aslam A. Efectos cronológicos de la terapia con antiinflamatorios no esteroideos sobre el estrés oxidativo y el estado antioxidante en pacientes con artritis reumatoide. Clin Rheumatol. 2021;40:1767–78. doi: 10.1007/s10067-020-05438-0. [ DOI ] [ PubMed ] [ Google Académico ]
- 5.Smolen JS, Landewé R, Breedveld FC, et al. Recomendaciones de la EULAR para el tratamiento de la artritis reumatoide con fármacos antirreumáticos modificadores de la enfermedad sintéticos y biológicos: actualización de 2013. Ann Rheum Dis. 2014;73:492–509. doi: 10.1136/annrheumdis-2013-204573. [ DOI ] [ Artículo gratuito de PMC ] [ PubMed ] [ Google Académico ]
- 6.Singh JA, Saag KG, Bridges SL, et al. Guía del Colegio Americano de Reumatología de 2015 para el tratamiento de la artritis reumatoide. Arthritis Care Res (Hoboken) 2016;68:1–25. doi: 10.1002/acr.22783. [ DOI ] [ PubMed ] [ Google Académico ]
- 7.Grupo de Estudio de Glucocorticoides en Dosis Bajas del Consejo de Artritis y Reumatismo Kirwan JR. Efecto de los glucocorticoides en la destrucción articular en la artritis reumatoide. N Engl J Med. 1995;333:142–6. doi: 10.1056/NEJM199507203330302. [ DOI ] [ PubMed ] [ Google Académico ]
- 8.Yasir M, Goyal A, Sonthalia S. StatPearls [Internet] Treasure Island, FL: StatPearls Publishing; 3 de julio de 2023. 3 de enero de 2023 [consultado el 5 de octubre de 2023]. Efectos adversos de los corticosteroides. Disponible en: https://www.ncbi.nlm.nih.gov/books/NBK531462/ [ PubMed ] [ Google Scholar ]
- 9.Szostak B, Machaj F, Rosik J, Pawlik A. Uso de la farmacogenética para predecir la respuesta al metotrexato en pacientes con artritis reumatoide. Expert Opin Drug Metab Toxicol. 2020;16:617–26. doi: 10.1080/17425255.2020.1777279. [ DOI ] [ PubMed ] [ Google Académico ]
- 10.Ramiro S, Gaujoux-Viala C, Nam JL, et al. Seguridad de los FAME sintéticos y biológicos: una revisión sistemática de la literatura que fundamenta la actualización de 2013 de las recomendaciones de la EULAR para el tratamiento de la artritis reumatoide. Ann Rheum Dis. 2014;73:529–35. doi: 10.1136/annrheumdis-2013-204575. [ DOI ] [ PubMed ] [ Google Académico ]
- 11.Baron EP. Revisión exhaustiva de la marihuana medicinal, los cannabinoides y sus implicaciones terapéuticas en la medicina y la cefalea: ¡qué viaje tan largo y extraño! Cefalea. 2015;55:885–916. doi: 10.1111/head.12570. [ DOI ] [ PubMed ] [ Google Académico ]
- 12.Gould J. El cultivo de cannabis. Nature. 2015;525:S2–3. doi: 10.1038/525S2a. [ DOI ] [ PubMed ] [ Google Académico ]
- 13.Andre CM, Hausman JF, Guerriero G. Cannabis sativa: la planta de las mil y una moléculas. Front Plant Sci. 2016;7:19. doi: 10.3389/fpls.2016.00019. [ DOI ] [ Artículo gratuito de PMC ] [ PubMed ] [ Google Académico ]
- 14.Mackie K. Receptores cannabinoides: dónde se encuentran y qué hacen. J Neuroendocrinol. 2008;(Supl. 1):10–14. doi: 10.1111/j.1365-2826.2008.01671.x. [ DOI ] [ PubMed ] [ Google Académico ]
- 15.Smith TH, Sim-Selley LJ, Selley DE. Proteínas que interactúan con el receptor cannabinoide CB1: ¿Nuevas dianas para el descubrimiento de fármacos en el sistema nervioso central? Br J Pharmacol. 2010;160:454–66. doi: 10.1111/j.1476-5381.2010.00777.x. [ DOI ] [ Artículo gratuito de PMC ] [ PubMed ] [ Google Académico ]
- dieciséis.Paland N, Pechkovsky A, Aswad M, et al. Inmunopatología de la COVID-19 y el paradigma del cannabis. Front Immunol. 2021;12:327. doi: 10.3389/fimmu.2021.631233. [ DOI ] [ Artículo gratuito de PMC ] [ PubMed ] [ Google Académico ]
- 17.Rosenbaum DM, Rasmussen SGF, Kobilka BK. Estructura y función de los receptores acoplados a proteína G. Nature. 2009;459:356–63. doi: 10.1038/nature08144. [ DOI ] [ Artículo gratuito de PMC ] [ PubMed ] [ Google Académico ]
- 18.Marsicano G, Kuner R. Distribución anatómica de receptores, ligandos y enzimas en el cerebro y la médula espinal: circuitos y neuroquímica. En: Köfalvi A, editor. Cannabinoides y el cerebro. Nueva York, NY: Springer; 2008, págs. 161-201. [ Google Académico ]
- 19.Zimmer A, Zimmer AM, Hohmann AG, Herkenham M, Bonner TI. Aumento de la mortalidad, hipoactividad e hipoalgesia en ratones deficientes en el receptor cannabinoide CB1. Proc Natl Acad Sci US A. 1999;96:5780–5. doi: 10.1073/pnas.96.10.5780. [ DOI ] [ Artículo gratuito de PMC ] [ PubMed ] [ Google Académico ]
- 20.Salort G, Álvaro-Bartolomé M, García-Sevilla JA. Regulación de la actividad constitutiva del receptor cannabinoide CB2 in vivo: tratamientos repetidos con agonistas inversos revierten la activación aguda de JNK y la señalización apoptótica asociada en cerebro de ratón. Psychopharmacology (Berl) 2017;234:925–41. doi: 10.1007/s00213-017-4537-5. [ DOI ] [ PubMed ] [ Google Scholar ]
- 21.Palazuelos J, Aguado T, Pazos MR, et al. Los receptores cannabinoides CB2 microgliales son neuroprotectores en la excitotoxicidad de la enfermedad de Huntington. Brain. 2009;132:3152–64. doi: 10.1093/brain/awp239. [ DOI ] [ PubMed ] [ Google Académico ]
- 22.Berdyshev EV. Receptores cannabinoides y regulación de la respuesta inmunitaria. Chem Phys Lipids. 2000;108:169–90. doi: 10.1016/S0009-3084(00)00195-X. [ DOI ] [ PubMed ] [ Google Académico ]
- 23.Ben-Shabat S, Hanuš LO, Katzavian G, Gallily R. Nuevos derivados del cannabidiol: síntesis, unión al receptor cannabinoide y evaluación de su actividad antiinflamatoria. J Med Chem. 2006;49:1113–17. doi: 10.1021/jm050709m. [ DOI ] [ PubMed ] [ Google Académico ]
- 24.Aswad M, Hamza H, Pechkovsky A, et al. El extracto con alto contenido de CBD (CBD-X) disminuye la actividad de las citocinas sistémica y localmente en pulmones inflamados. Front Immunol. 2022;13:875546. doi: 10.3389/fimmu.2022.875546. [ DOI ] [ Artículo gratuito de PMC ] [ PubMed ] [ Google Académico ]
- 25.Klein TW, Newton CA, Nakachi N, Friedman H. El tratamiento con 9-tetrahidrocannabinol suprime la inmunidad y las respuestas tempranas de IFN-γ, IL-12 y del receptor 2 de IL-12 a la infección por Legionella pneumophila 1. J Immunol. 2000;164:6461–6. doi: 10.4049/jimmunol.164.12.6461. [ DOI ] [ PubMed ] [ Google Scholar ]
- 26.Jeon YJ, Yang KH, Pulaski JT, Kaminski NE. La atenuación de la expresión génica de la óxido nítrico sintasa inducible por delta-9-tetrahidrocannabinol está mediada por la inhibición de la activación del factor nuclear kappa B/Rel. Mol Pharmacol. 1996;50:334–41. https://pubmed.ncbi.nlm.nih.gov/8700141/ [ PubMed ] [ Google Académico ]
- 27.Kisková T, Mungenast F, Suváková M, Jäger W, Thalhammer T. Aspectos futuros de los cannabinoides en la terapia del cáncer de mama. Int J Mol Sci. 2019;20:1673. doi: 10.3390/ijms20071673. [ DOI ] [ Artículo gratuito de PMC ] [ PubMed ] [ Google Académico ]
- 28.Kozela E, Pietr M, Juknat A, Rimmerman N, Levy R, Vogel Z. Los cannabinoides Δ9-tetrahidrocannabinol y cannabidiol inhiben diferencialmente las vías proinflamatorias NF-κappaB activadas por lipopolisacáridos e interferón-β/STAT en células microgliales BV-2. J Biol Chem. 2010;285:1616–26. doi: 10.1074/jbc.M109.069294. [ DOI ] [ Artículo gratuito de PMC ] [ PubMed ] [ Google Académico ]
- 29.Juknat A, Gao F, Coppola G, Vogel Z, Kozela E. Perfiles de expresión de miRNA y redes moleculares en la microglía BV-2 en reposo y activada por LPS: efecto de los cannabinoides. PLoS One. 2019;14:e0212039. doi: 10.1371/journal.pone.0212039. [ DOI ] [ Artículo gratuito de PMC ] [ PubMed ] [ Google Académico ]
- 30.Mbvundula EC, Bunning RAD, Rainsford KD. Artritis y cannabinoides: HU-210 y Win-55,212-2 previenen la degradación de la matriz inducida por IL-1α en condrocitos articulares bovinos in vitro. J Pharm Pharmacol. 2010;58:351–8. doi: 10.1211/jpp.58.3.0009. [ DOI ] [ PubMed ] [ Google Académico ]
- 31.Mbvundula EC, Bunning RAD, Rainsford KD. Efectos de los cannabinoides en la producción de óxido nítrico por los condrocitos y la degradación de proteoglicanos en el cartílago. Biochem Pharmacol. 2005;69:635–40. doi: 10.1016/j.bcp.2004.11.018. [ DOI ] [ PubMed ] [ Google Académico ]
- 32.Zurier RB, Rossetti RG, Lane JH, Goldberg JM, Hunter SA, Burstein SH. Ácido dimetilheptil-THC-11 OIC: un agente antiinflamatorio no psicoactivo con una estructura cannabinoide molde. Arthritis Rheum. 1998;41:163–70. doi: 10.1002/1529-0131(199801)41:1<163::AID-ART20>3.0.CO;2-9. [ DOI ] [ PubMed ] [ Google Académico ]
- 33.Palomares B, Ruiz-Pino F, Garrido-Rodríguez M, et al. El ácido tetrahidrocannabinólico A (THCA-A) reduce la adiposidad y previene enfermedades metabólicas causadas por la obesidad inducida por la dieta. Biochem Pharmacol. 2020;171:113693. doi: 10.1016/j.bcp.2019.113693. [ DOI ] [ PubMed ] [ Google Académico ]
- 34.Smith FL, Fujimori K, Lowe J, Welch SP. Caracterización de la antinocicepción por Δ9-tetrahidrocannabinol y anandamida en ratas con y sin artritis. Pharmacol Biochem Behav. 1998;60:183–91. doi: 10.1016/S0091-3057(97)00583-2. [ DOI ] [ PubMed ] [ Google Académico ]
- 35.Malfait AM, Gallily R, Sumariwalla PF, et al. El cannabidiol, componente no psicoactivo del cannabis, es un tratamiento antiartrítico oral para la artritis murina inducida por colágeno. Proc Natl Acad Sci US A. 2000;97:9561–6. doi: 10.1073/pnas.160105897. [ DOI ] [ Artículo gratuito de PMC ] [ PubMed ] [ Google Académico ]
- 36.Cox ML, Haller VL, Welch SP. El efecto antinociceptivo del Δ9-tetrahidrocannabinol en ratas con artritis afecta al receptor cannabinoide CB2. Eur J Pharmacol. 2007;570:50–6. doi: 10.1016/j.ejphar.2007.05.024. [ DOI ] [ PubMed ] [ Google Académico ]
- 37.Sumariwalla PF, Gallily R, Tchilibon S, Fride E, Mechoulam R, Feldmann M. Un nuevo ácido cannabinoide sintético no psicoactivo (HU-320) con propiedades antiinflamatorias en la artritis murina inducida por colágeno. Arthritis Rheum. 2004;50:985–98. doi: 10.1002/art.20050. [ DOI ] [ PubMed ] [ Google Académico ]
- 38.Hammell DC, Zhang LP, Ma F, et al. El cannabidiol transdérmico reduce la inflamación y las conductas relacionadas con el dolor en un modelo de artritis en ratas. Eur J Pain. 2016;20:936–48. doi: 10.1002/ejp.818. [ DOI ] [ Artículo gratuito de PMC ] [ PubMed ] [ Google Académico ]
- 39.Richardson D, Pearson RG, Kurian N, et al. Caracterización del sistema receptor de cannabinoides en el tejido y líquido sinovial en pacientes con osteoartritis y artritis reumatoide. Arthritis Res Ther. 2008;10:R43. doi: 10.1186/ar2401. [ DOI ] [ Artículo gratuito de PMC ] [ PubMed ] [ Google Académico ]
- 40.McInnes IB, Schett G. Citocinas en la patogénesis de la artritis reumatoide. Nat Rev Immunol. 2007;7:429–42. doi: 10.1038/nri2094. [ DOI ] [ PubMed ] [ Google Académico ]
- 41.Rengel Y, Ospelt C, Gay S. Proteinasas en la articulación: relevancia clínica de las proteinasas en la destrucción articular. Arthritis Res Ther. 2007;9:221. doi: 10.1186/ar2304. [ DOI ] [ Artículo gratuito de PMC ] [ PubMed ] [ Google Académico ]
- 42.Johnson DR, Stebulis JA, Rossetti RG, Burstein SH, Zurier RB. Supresión de las metaloproteinasas de fibroblastos por ácido ajulémico, un ácido cannabinoide no psicoactivo. J Cell Biochem. 2007;100:184–90. doi: 10.1002/jcb.21046. [ DOI ] [ PubMed ] [ Google Académico ]
- 43.Selvi E, Lorenzini S, Garcia-Gonzalez E, et al. Efecto inhibidor de los cannabinoides sintéticos sobre la producción de citocinas en sinoviocitos similares a fibroblastos reumatoides. Clin Exp Rheumatol. 2008;26:574–81. https://pubmed.ncbi.nlm.nih.gov/18799087/ [ PubMed ] [ Google Académico ]
- 44.Lowin T, Pongratz G, Straub RH. El mesilato del cannabinoide sintético WIN55,212-2 disminuye la producción de mediadores inflamatorios en fibroblastos sinoviales de artritis reumatoide mediante la activación de CB2, TRPV1, TRPA1 y receptores diana aún no identificados. J Inflamm (Londres) 2016;13:15. doi: 10.1186/s12950-016-0114-7. [ DOI ] [ Artículo gratuito de PMC ] [ PubMed ] [ Google Académico ]
- 45.Lowin T, Tingting R, Zurmahr J, Classen T, Schneider M, Pongratz G. Cannabidiol (CBD): un inhibidor de los fibroblastos sinoviales de la artritis reumatoide inflamatoria. Cell Death Dis. 2020;11:714. doi: 10.1038/s41419-020-02892-1. [ DOI ] [ Artículo gratuito de PMC ] [ PubMed ] [ Google Académico ]
- 46.Verrico CD, Wesson S, Konduri V, et al. Estudio aleatorizado, doble ciego y controlado con placebo sobre la administración diaria de cannabidiol para el tratamiento del dolor por osteoartritis canina. Pain. 2020;161:2191–202. doi: 10.1097/j.pain.0000000000001896. [ DOI ] [ Artículo gratuito de PMC ] [ PubMed ] [ Google Académico ]
- 47.Kotschenreuther K, Waqué I, Yan S, et al. Los cannabinoides impulsan la diferenciación de células Th17 en pacientes con enfermedades reumáticas autoinmunes. Cell Mol Immunol. 2021;18:764–6. doi: 10.1038/s41423-020-0437-4. [ DOI ] [ Artículo gratuito de PMC ] [ PubMed ] [ Google Académico ]
- 48.Notcutt W, Price M, Miller R, et al. Experiencias iniciales con extractos medicinales de cannabis para el dolor crónico: resultados de 34 estudios "N de 1". Anestesia. 2004;59:440–52. doi: 10.1111/j.1365-2044.2004.03674.x. [ DOI ] [ PubMed ] [ Google Académico ]
- 49.Blake DR, Robson P, Ho M, Jubb RW, McCabe CS. Evaluación preliminar de la eficacia, tolerabilidad y seguridad de un medicamento a base de cannabis (Sativex) en el tratamiento del dolor causado por la artritis reumatoide. Reumatología (Oxford) 2006;45:50–2. doi: 10.1093/rheumatology/kei183. [ DOI ] [ PubMed ] [ Google Académico ]
- 50.Wilsey B, Marcotte T, Deutsch R, Gouaux B, Sakai S, Donaghe H. El cannabis vaporizado en dosis bajas mejora significativamente el dolor neuropático. J Pain. 2013;14:136–48. doi: 10.1016/j.jpain.2012.10.009. [ DOI ] [ Artículo gratuito de PMC ] [ PubMed ] [ Google Académico ]
- 51.Van De Donk T, Niesters M, Kowal MA, Olofsen E, Dahan A, Van Velzen M. Un estudio experimental aleatorizado sobre los efectos analgésicos del cannabis de grado farmacéutico en pacientes con dolor crónico y fibromialgia. Pain. 2019;160:860–9. doi: 10.1097/j.pain.0000000000001464. [ DOI ] [ Artículo gratuito de PMC ] [ PubMed ] [ Google Académico ]
- 52.Haleem R, Wright R. Una revisión exploratoria de ensayos clínicos sobre la reducción del dolor con la administración de cannabis en adultos. J Clin Med Res. 2020;12:344–51. doi: 10.14740/jocmr4210. [ DOI ] [ Artículo gratuito de PMC ] [ PubMed ] [ Google Académico ]
- 53.Van den Berg M, John M, Black M, et al. Productos medicinales a base de cannabis para la artritis: un doloroso dilema. NZ Med J. 2020;133:35–45. https://pubmed.ncbi.nlm.nih.gov/32438375/ [ PubMed ] [ Google Académico ]
- 54.Weizman L, Dayan L, Brill S, et al. La analgesia con cannabis en el dolor neuropático crónico se asocia con alteraciones de la conectividad cerebral. Neurología. 2018;91:e1285–94. doi: 10.1212/WNL.0000000000006293. [ DOI ] [ Artículo gratuito de PMC ] [ PubMed ] [ Google Académico ]
- 55.Ste-Marie PA, Shir Y, Rampakakis E, et al. Encuesta sobre el consumo de cannabis (marihuana) en pacientes de reumatología con diagnóstico confirmado por un reumatólogo. Pain. 2016;157:2792–7. doi: 10.1097/j.pain.0000000000000706. [ DOI ] [ PubMed ] [ Google Scholar ]
- 56.Häuser W, Petzke F, Fitzcharles MA. Eficacia, tolerabilidad y seguridad de los medicamentos a base de cannabis para el manejo del dolor crónico: una revisión sistemática. Eur J Pain. 2018;22:455–70. doi: 10.1002/ejp.1118. [ DOI ] [ PubMed ] [ Google Académico ]
- 57.Jennings JM, Williams MA, Levy DL, Johnson RM, Eschen CL, Dennis DA. ¿Ha cambiado el consumo de marihuana autodeclarado en pacientes sometidos a artroplastia total tras la legalización de la marihuana? Clin Orthop Relat Res. 2019;477:95–100. doi: 10.1097/CORR.0000000000000339. [ DOI ] [ Artículo gratuito de PMC ] [ PubMed ] [ Google Académico ]
- 58.Ware MA, Adams H, Guy GW. El uso medicinal del cannabis en el Reino Unido: resultados de una encuesta nacional. Int J Clin Pract. 2005;59:291–5. doi: 10.1111/j.1742-1241.2004.00271.x. [ DOI ] [ PubMed ] [ Google Académico ]
- 59.Guillouard M, Authier N, Pereira B, Soubrier M, Mathieu S. Evaluación del consumo de cannabis y su impacto en el dolor en enfermedades reumatológicas: una revisión sistemática y un metanálisis. Reumatología (Oxford) 2021;60:549–56. doi: 10.1093/rheumatology/keaa534. [ DOI ] [ PubMed ] [ Google Académico ]
- 60.Fitzcharles MA, Rampakakis E, Sampalis J, et al. Consumo de cannabis medicinal por pacientes reumatológicos tras la legalización recreativa: un estudio observacional prospectivo de 1000 pacientes en Canadá. ACR Open Rheumatol. 2020;2:286–93. doi: 10.1002/acr2.11138. [ DOI ] [ Artículo gratuito de PMC ] [ PubMed ] [ Google Académico ]
- 61.Urits I, Charipova K, Gress K, et al. Efectos adversos del cannabis recreativo y medicinal. Psychopharmacol Bull. 2021;51:94–109. http://www.ncbi.nlm.nih.gov/pmc/articles/pmc8063125/ [ Artículo gratuito de PMC ] [ PubMed ] [ Google Académico ]
- 62.Mesinga TjT, de Vries I, Kruidenier M, et al. Un estudio cruzado, doble ciego, aleatorizado, controlado con placebo sobre la farmacocinética y los efectos del cannabis. Rijksinstituut voor Volksgezondheid en Milieu RIVM. 2006. Disponible en: http://hdl.handle.net/10029/7272 .
- 63.Asbridge M, Hayden JA, Cartwright JL. Consumo agudo de cannabis y riesgo de colisión vehicular: revisión sistemática de estudios observacionales y metaanálisis. BMJ. 2012;344:e536. doi: 10.1136/bmj.e536. [ DOI ] [ Artículo gratuito de PMC ] [ PubMed ] [ Google Académico ]
- 64.Legrand SA, Isalberti C, der Linden TV, et al. Alcohol y drogas en conductores con lesiones graves en seis países europeos. Drug Test Anal. 2013;5:156–65. doi: 10.1002/dta.1393. [ DOI ] [ PubMed ] [ Google Académico ]
- 65.Aryana A, Williams MA. La marihuana como desencadenante de eventos cardiovasculares: ¿especulación o certeza científica? Int J Cardiol. 2007;118:141–4. doi: 10.1016/j.ijcard.2006.08.001. [ DOI ] [ PubMed ] [ Google Académico ]
- 66.Thomas G, Kloner RA, Rezkalla S. Efectos adversos cardiovasculares, cerebrovasculares y vasculares periféricos de la inhalación de marihuana: lo que los cardiólogos deben saber. Am J Cardiol. 2014;113:187–90. doi: 10.1016/j.amjcard.2013.09.042. [ DOI ] [ PubMed ] [ Google Académico ]
- 67.Jouanjus E, Lapeyre-Mestre M, Micallef J. Consumo de cannabis: señal de un riesgo creciente de trastornos cardiovasculares graves. J Am Heart Assoc. 2014;3:e000638. doi: 10.1161/JAHA.113.000638. [ DOI ] [ Artículo gratuito de PMC ] [ PubMed ] [ Google Académico ]
- 68.deShazo RD, Parker SB, Williams D, et al. Efectos de la marihuana en la estructura y función cerebral: ¿Qué sabemos y qué debemos hacer? Una breve revisión y comentario. Am J Med. 2019;132:281–5. doi: 10.1016/j.amjmed.2018.09.006. [ DOI ] [ PubMed ] [ Google Académico ]
- 69.Cohen N, Fedewa S, Chen AY. Epidemiología y demografía de la población con cáncer de cabeza y cuello. Oral Maxillofac Surg Clin North Am. 2018;30:381–95. doi: 10.1016/j.coms.2018.06.001. [ DOI ] [ PubMed ] [ Google Académico ]
- 70.Busch FW, Seid DA, Wei ET. Actividad mutagénica de los condensados del humo de marihuana. Cancer Lett. 1979;6:319–24. doi: 10.1016/S0304-3835(79)80088-9. [ DOI ] [ PubMed ] [ Google Académico ]
- 71.Aston E. NCT04269993 : Impacto de la administración aguda de cannabis en la sintomatología del dolor y los marcadores inflamatorios en pacientes con artritis reumatoide o psoriásica. ClinicalTrials.gov. Publicado el 17 de febrero de 2020. Disponible en: https://clinicaltrials.gov/ct2/show/NCT04269993 .
- 72.Sylvain M. NCT04402554 : Encuesta sobre el consumo de cannabis en pacientes con artritis inflamatoria crónica (CannabisRIC). ClinicalTrials.gov. Última actualización: 2 de junio de 2021. Disponible en: https://clinicaltrials.gov/ct2/show/NCT04402554 .
- 73.Wang B, Kovalchuk A, Li D, et al. En busca de estrategias preventivas: nuevos extractos de Cannabis sativa con alto contenido de CBD modulan la expresión de ECA2 en los tejidos de entrada de la COVID-19. Aging (Albany, NY) 2020;12:22425–44. doi: 10.18632/aging.202225. [ DOI ] [ Artículo gratuito de PMC ] [ PubMed ] [ Google Académico ]