https://pmc.ncbi.nlm.nih.gov/articles/PMC9148011
Vida (Basilea). 5 de mayo de 2022;12(5):682. doi:
La eficacia del cannabis en los síntomas relacionados con la esclerosis múltiple
Fatma Haddad 1, 2 , Ghadeer Dokmak 1 , Rafik Karaman 1, 3, *
Arianna Di Stadio
- Información del autor
- Notas del artículo
- Información sobre derechos de autor y licencias
ID de producto: PMC9148011 ID de producto:
Abstracto
La esclerosis múltiple (EM) es una enfermedad autoinmune que daña las neuronas del sistema nervioso central. Sus síntomas más comunes son espasticidad, espasmos musculares, dolor neuropático, temblores, disfunción vesical, disartria y algunos problemas intelectuales, incluyendo alteraciones de la memoria. Se han realizado varios estudios clínicos para investigar los efectos del cannabis en el alivio de estos síntomas en pacientes con EM. En esta revisión se evaluó la eficacia de Cannabis sativa ( C. Sativa ) en el tratamiento de los síntomas de la EM, como espasticidad, dolor, temblores, ataxia, función vesical, sueño, calidad de vida y efectos adversos. La mayoría de los estudios clínicos mostraron los efectos positivos de los cannabinoides con sus diferentes vías de administración, como el aerosol oromucosal y la forma oral, en la reducción de la mayoría de los síntomas de la EM. El aerosol oromucosal Nabiximols demostró una mejora en la reducción de la espasticidad, el dolor y la calidad de vida de la EM con un efecto adverso tolerado. Los cannabinoides orales son significativamente eficaces para tratar el dolor y la espasticidad de la EM, mientras que los demás síntomas indican una leve mejoría y la evidencia es bastante inconsistente. El espray oromucosal y el cannabis oral se utilizan principalmente para tratar a pacientes con EM y tienen efectos positivos en el tratamiento de los síntomas más comunes de la EM, como el dolor y la espasticidad, mientras que los demás síntomas de la EM mostraron una leve mejoría, por lo que se necesitan más estudios.
Palabras clave: Cannabis sativa , marihuana, cannabinoides, 9-tetrahidrocannabinol (THC), esclerosis múltiple (EM)
1. Introducción
La EM es una enfermedad neurológica de origen autoinmune que afecta y daña el sistema nervioso central y afecta a 2,3 millones de personas en todo el mundo [ 1 , 2 ]. Esta enfermedad desmielinizante provoca un deterioro grave de la transmisión de señales nerviosas entre el cerebro y la médula espinal que causa una pérdida de la vaina de mielina [ 1 , 2 ]. La EM se ha caracterizado por síntomas de espasticidad, espasmos musculares, temblores, disfunción de la vejiga, dolor neuropático, disartria y algunos problemas intelectuales, incluidos trastornos de la memoria [ 3 , 4 ]. Se han autorizado algunos fármacos para ralentizar la progresión de la enfermedad y reducir la frecuencia de recaídas [ 3 ]. Sin embargo, se necesitan más estudios para aliviar aún más los síntomas discapacitantes de los pacientes con EM.
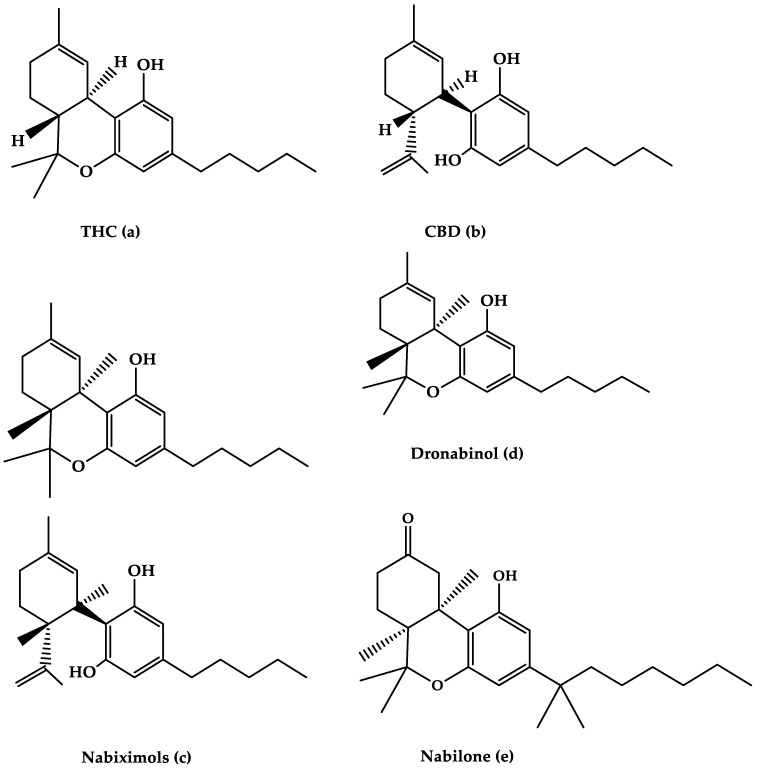
En el siglo XXI, la planta Sativa se ha convertido en la droga ilícita más utilizada [ 5 ]. También se la conoce como cáñamo, cannabis o marihuana, y viene en una variedad de formas, incluidos cigarrillos o pipas de hachís y dulces o brownies [ 5 , 6 ]. La planta de cannabis, que incluye más de 560 componentes identificados, está compuesta principalmente de fitoquímicos [ 5 ]. Las dos especies principales de la planta de Cannabis, que se utilizan principalmente con fines recreativos y medicinales, son Cannabis indica y Cannabis sativa ( C. Sativa ) [ 7 , 8 ]. Ambas plantas están compuestas de diferentes composiciones de cannabinoides de THC y CBD [ 9 , 10 ]. Investigaciones anteriores han demostrado los diferentes efectos de cada especie debido a las diferentes concentraciones de los dos componentes principales [ 11 ]. C. Sativa tiene una mayor proporción de CBD a THC y lo contrario se observa para C. indica [ 10 ]. Existen alrededor de 100 cannabinoides en Cannabis sativa [ 12 ], siendo los más conocidos el 9-tetrahidrocannabinol (THC) y el cannabidiol (CBD) ( Figuras 1 a, b). El sistema cannabinoide endógeno, que incluye los receptores CB1 y CB2, es donde los cannabinoides obtienen sus efectos. Los efectos psicotrópicos del THC están mediados principalmente por acciones agonistas del receptor CB1. Por otro lado, se ha planteado la hipótesis de que el CBD se une a los receptores CB1 y CB2 y actúa como antagonista [ 5 , 13 ].
El cannabis se ha utilizado durante más de 5000 años, y el descubrimiento del sistema cannabinoide endógeno se produjo hace más de una década. CB1 y CB2 son receptores cannabinoides que están vinculados negativamente a la adenilil ciclasa y positivamente a la proteína quinasa activada por mitógenos a través de la proteína Gi/o [ 14 , 15 ]. CB1 y CB2 se distribuyen en los sistemas nerviosos central y periférico, y en el sistema inmunitario [ 16 ]. Los receptores CB1 se encuentran principalmente en las terminales nerviosas del sistema nervioso central y en algunos tejidos periféricos, y están vinculados a un tipo específico de canal de calcio y potasio a través de una proteína G. Dado que bloquea las vías del dolor en el cerebro y la médula espinal, la principal función del receptor CB1 es suprimir la liberación de neurotransmisores y desempeña un papel crucial en la mediación del efecto analgésico del cannabis [ 17 ].
Los fitocannabinoides, los endocannabinoides y los cannabinoides sintéticos son los tres tipos de cannabinoides. Los principales componentes químicos del cannabis son los fitocannabinoides, que incluyen diversos compuestos fenólicos terpénicos no cannabinoides C21, o C22 para el grupo carboxilato, que se sintetiza en gran medida en el cannabis [ 18 , 19 ]. El calor puede descarboxilar los fitocannabinoides, que se biosintetizan en forma carboxilada [ 20 ].
El cannabis se considera un agente antiinflamatorio e inmunosupresor prometedor debido a sus acciones centrales y periféricas en los receptores CB1 y CB2 que median diferentes vías intracelulares cuando se activan [ 21 ]. Además de los efectos de los cannabinoides en los receptores CB1 y CB2, los cannabinoides tienen efectos en los receptores nucleares y canales iónicos por su actividad en otros receptores acoplados a proteína G transmembrana (GPCR) y tienen una actividad moduladora en los receptores opioides y serotonina [ 16 ]. El THC es un componente psicoactivo del cannabis con la mayor potencia. El THC se puede utilizar para tratar el dolor neuropático y crónico debido a sus propiedades intoxicantes, antieméticas y antiinflamatorias [ 22 ]. El CBD no causa psicosis, aunque sí tiene efectos farmacológicos sobre el dolor y la espasticidad [ 23 ].
El principal componente psicoactivo de la planta C. Sativa , el 9-THC, se descubrió a fines de la década de 1980 y se demostró que tiene actividad en un receptor cannabinoide específico en el cerebro (el receptor cannabinoide CB1), lo que tuvo un gran impacto en el desarrollo de medicamentos terapéuticos cannabinoides y su potencial para aliviar los síntomas de espasticidad de la EM [ 24 ]. Estudios preclínicos en animales de EM sugirieron que los cannabinoides tienen efectos antisépticos debido a la activación de los receptores CB1, que inhiben la liberación de neurotransmisores clásicos, como la glutamina, mientras que también disminuyen la excitabilidad neuronal al activar los canales de potasio somáticos y dendríticos [ 25 , 26 ].
El CBD es un cannabinoide no psicotrópico clave presente en C. sativa , que representa hasta el 40 % del extracto de la planta de cannabis y se une a una amplia gama de dianas fisiológicas del sistema endocannabinoide del cuerpo humano. El CBD ha demostrado potencial en el tratamiento de los síntomas de la EM. En particular, se ha demostrado en numerosos ensayos que el CBD reduce la rigidez, el malestar, la inflamación, el agotamiento y la depresión en pacientes con EM, lo que resulta en una mayor movilidad [ 27 , 28 ]. El CBD también afecta a los receptores no cannabinoides GPCR y a los canales iónicos, lo que conduce a la regulación del dolor y a efectos antiinflamatorios mediante la modulación de los receptores [ 16 ].
Se han realizado varios intentos para determinar el factor genético primario que contribuye a la progresión y gravedad de la EM [ 29 , 30 , 31 ]. Aunque se demostró que los efectos genéticos en la gravedad y susceptibilidad de la enfermedad de EM son poligénicos con una influencia modesta [ 30 , 31 ], se necesitan más estudios para comprender mejor la farmacogenética de la enfermedad de EM y definir el objetivo molecular del CBD en pacientes con EM realizando una investigación ex vivo/in vitro en células inmunes humanas como lo informaron Furgiuele et al. [ 31 ].
En esta revisión se evalúa la eficacia del nabixiomol en aerosol oromucosal, el dronabinol oral y la nabilona oral en presentaciones de cannabis para la espasticidad, el dolor, el temblor, la función urinaria, los trastornos del sueño, la calidad de vida, la discapacidad y su progresión relacionados con la EM. Las siguientes secciones describen los signos y síntomas de la EM, así como las opciones de tratamiento.
1.1 Síntomas relacionados con la EM
1.1.1. Espasticidad en la EM
La espasticidad es un síntoma común de la EM, que afecta a entre el 60 y el 84 % de los pacientes, en particular durante la progresión de la enfermedad [ 32 ]. La espasticidad es causada por una lesión de las neuronas motoras de corticosteroides superiores, así como por un impulso supraespinal aberrante de los reflejos espinales [ 33 ], que puede exacerbar otros síntomas de la EM y perjudicar la calidad de vida del paciente [ 34 , 35 , 36 ].
La espasticidad en la EM es una afección compleja que se caracteriza por su síntoma más frecuente, la rigidez muscular, inducida por la hiperexcitabilidad del reflejo de estiramiento. La fatiga, el malestar y la disfunción vesical se encuentran entre los síntomas más frecuentes y problemáticos [ 37 ]. La combinación de terapias no farmacológicas y farmacológicas es el tratamiento más común [ 38 ]. La creciente gravedad de la espasticidad en la EM conlleva una menor satisfacción del paciente, y la farmacoterapia oral disponible para tratarla es limitada e ineficaz [ 39 ].
La terapia para la espasticidad en la EM se utiliza para mejorar la capacidad funcional, facilitar la rehabilitación, evitar contracturas y aliviar las molestias en personas con EM. El único uso de cannabinoides en trastornos neurológicos y la única intervención de medicina complementaria con alta evidencia de eficacia en la EM son los cannabinoides farmacéuticos para la espasticidad, según los estudios más recientes [ 40 , 41 ].
El tratamiento más frecuente y disponible para la espasticidad de la EM es multimodal [ 38 ], que combina terapias no farmacológicas y farmacéuticas. La mayoría de los enfoques terapéuticos actuales resultan en insatisfacción del paciente. Se ha creado una nueva opción farmacéutica basada en cannabis con diferentes métodos de administración. Sorprendentemente, la mayoría de los estudios revelaron que el cannabis tópico era el más comúnmente utilizado para tratar la espasticidad de la EM debido a sus cualidades farmacocinéticas, aunque fumar o vapear fue la estrategia más popular en otros estudios [ 42 , 43 ]. THC y THC: El CBD es el cannabinoide más comúnmente utilizado para tratar la espasticidad, según las revisiones de Ben Amar, Koppel et al., Lakhan, Rowland y Krast et al. [ 40 , 44 , 45 , 46 ].
1.1.2. Dolor relacionado con la EM
La EM se relaciona frecuentemente con el dolor [ 47 ]. El dolor ha sido reconocido desde hace mucho tiempo como un elemento significativo en la calidad de vida relacionada con la salud general (CVRS) de los pacientes con EM. Los pacientes con EM que tienen dolor han reportado una disminución de la CVRS, así como disfunciones físicas y emocionales [ 48 , 49 ]. La lesión neurológica, así como la disfunción e incapacidad neurológica, podrían ser la fuente de un malestar intenso [ 50 ]. El dolor neuropático central continuo, el dolor neuropático central intermitente, el dolor musculoesquelético y el dolor neuropático y no neuropático mixto son ejemplos de dolor asociado con la EM [ 49 ]. A pesar de los avances significativos en el suministro de nuevas técnicas terapéuticas para el tratamiento sintomático de la EM, como el dolor, las modalidades terapéuticas actuales son insuficientes para satisfacer las necesidades de los pacientes [ 50 , 51 ].
1.1.3. Temblor y ataxia relacionados con la EM
La EM afecta el cerebelo y sus vías eferentes y aferentes, causando temblores, ataxia y disartria en síntomas agudos y crónicos [ 52 ]. Más del 80% de los pacientes con EM tienen temblores o ataxia en algún momento durante su enfermedad [ 53 ]. Varias farmacoterapias para el tratamiento de temblores o ataxia asociados con la EM están disponibles, pero a menudo son ineficaces [ 52 , 54 ]. Debido a que la eficacia absoluta y comparativa y la aceptabilidad de los tratamientos farmacéuticos no se registran adecuadamente, una revisión Cochrane de seis estudios controlados aleatorios para el tratamiento de la ataxia en la EM no pudo proporcionar ninguna recomendación [ 55 ]. Además, varios estudios controlados aleatorios han analizado el efecto de los extractos de cannabis en estos síntomas, pero han concluido que los cannabinoides son inútiles para tratar el temblor y la ataxia de la EM [ 40 , 55 , 56 , 57 ]. Como resultado, es prudente buscar tratamientos nuevos.
1.1.4. Disfunción vesical en la EM
En pacientes con EM, la disfunción del tracto urinario inferior es un síntoma prevalente. Suele aparecer en las últimas etapas de la enfermedad. En total, entre el 50 % y el 90 % de los pacientes con EM desarrollan este síntoma después de 6 años de enfermedad [ 58 , 59 , 60 ], que se atribuye principalmente a una vejiga hiperactiva neurogénica [ 61 ]. La urgencia urinaria y la incontinencia de urgencia pueden perjudicar la calidad de vida del paciente y causar inmovilidad. El autocateterismo anticolinérgico e intermitente puede ser beneficioso en las primeras etapas [ 62 ]. Un total de cuatro revisiones analizaron el efecto del cannabis en los síntomas de la función vesical en la EM [ 40 , 44 , 46 , 63 ].
1.1.5. Trastornos del sueño relacionados con la EM
Uno de los síntomas más prevalentes entre los pacientes con EM son los trastornos del sueño [ 64 ]. Las causas más comunes de los problemas de sueño en la EM son multifuncionales y están relacionadas con la inmunoterapia y las terapias sintomáticas, así como con los síntomas relacionados con la EM, como el dolor y el agotamiento [ 65 ]. Los pacientes con trastornos del sueño no tratados tienen un mayor riesgo de desarrollar enfermedades, lo que puede tener un impacto a largo plazo en su salud [ 66 , 67 , 68 ]. Tres estudios analizaron el impacto del cannabis en los problemas de sueño en la EM. Sin embargo, no se llegó a ninguna conclusión con respecto a los efectos clínicos del cannabis en pacientes con EM con dificultades para dormir [ 44 , 46 , 63 ].
1.1.6. Calidad de vida relacionada con la salud en pacientes con EM
La CVRS (calidad de vida relacionada con la salud) es una percepción multidimensional que abarca el funcionamiento físico, emocional, mental y social [ 69 ]. Se ha observado que los pacientes con EM tienen una CVRS más baja que la población general. La influencia negativa de los síntomas de la enfermedad en el desempeño de la vida diaria podría explicar la peor CVRS asociada con la EM [ 70 , 71 ]. En pacientes con EM, se investigó la influencia del cannabis en la CVRS, con resultados inconsistentes [ 46 , 54 , 72 ].
1.1.7. Discapacidad relacionada con la EM y progresión de la discapacidad
Progresión La EM es una enfermedad que causa discapacidad y se caracteriza por episodios neurológicos recurrentes y remitentes [ 73 ]. La progresión está relacionada con un tratamiento y diagnóstico inadecuados, lo que resulta en desmielinización, pérdida axonal y neuronal, y varios problemas cognitivos, sensoriales y motores [ 73 , 74 ]. Se produce como resultado de lesiones del sistema nervioso central y está impulsada por efectos inflamatorios centrales y otros efectos neurodegenerativos que sustentan la discapacidad irreversible. Muchos estudios analizaron el impacto del cannabis en el deterioro de la EM y los signos de progresión de la discapacidad [ 46 , 63 , 72 , 75 ]. La mayoría de estas revisiones no se centraron en la discapacidad por EM, y se trató como un resultado secundario sin conclusiones sobre el impacto de los cannabinoides en ella.
2. Agentes cannabinoides para el tratamiento de la EM
2.1. Nabiximoles
Nabiximols es el nombre genérico de Sativex ® , un aerosol oromucosal que contiene una proporción molecular de 1:1 de THC y CBD (Nabiximols (c), Figura 1 ) [ 76 ]. Se ha autorizado en varios países para el tratamiento de la espasticidad grave en pacientes con EM [ 5 ]. El THC, el CBD y la pequeña cantidad de otros componentes del extracto de la planta, incluidos otros cannabinoides y terpenoides disueltos en etanol, constituyen alrededor del 70% de los componentes de Nabiximols [ 76 ]. Hay 2,7 mg, 2,5 mg y 0,04 g de THC, CBD y etanol, respectivamente, en cada dosis de aerosol oromucosal. Su administración tiene un perfil farmacocinético favorable, con menos efectos de primer paso y una baja concentración plasmática, lo que evita los efectos psicoactivos causados por el cannabis fumado [ 76 , 77 , 78 ]. Además, su concentración plasmática máxima aumentaría gradualmente dentro de las 2 a 4 h posteriores a la administración, mientras que el efecto de inicio rápido aparecerá después de 15 a 40 h, lo que facilita los ajustes del tratamiento [ 77 ]. La interacción sinérgica se basa en una combinación de dosis baja de THC y CBD, que resulta en efectos eufóricos reducidos y beneficios terapéuticos antiespásticos mediados por cannabinoides mejorados [ 76 ]. Según muchas investigaciones, se recomienda comenzar la terapia con un período de titulación de dosis de 14 días para alcanzar hasta 12 pulverizaciones como la dosis más alta por día [ 78 ]. La distribución de dosis individual a lo largo de un día, así como el cambio de dosis durante el curso del tratamiento, es posible dependiendo de la intensidad de la enfermedad. La dosis diaria máxima recomendada es de 12 pulverizaciones con al menos 15 minutos entre cada pulverización [ 77 ]. Los nabiximols se probaron en pacientes con EM con una variedad de síntomas, como rigidez, dolor, temblor y función de la vejiga, en varias investigaciones clínicas [ 56 , 79 , 80 , 81 ]. Se encontró que los nabiximols tenían buenos efectos sobre la espasticidad, el dolor y la calidad de vida en pacientes con EM en la mayoría de los ensayos ( Tabla 1 ) [ 56 , 79 , 80 , 81 ].
Tabla 1.
La eficacia de las formas de cannabis en aerosol oromucosal nabixiomol, dronabinol oral y nabilona oral sobre los síntomas relacionados con la EM y sus efectos adversos.
| Agentes cannabinoides | Acciones terapéuticas | Efectos adversos |
|---|---|---|
| Nabiximols | Mejora significativa de la espasticidad, el dolor y los problemas de sueño relacionados con la EM.Efecto menor en el alivio de las disfunciones de la vejiga en pacientes con EM y efectos favorables pero efectos estadísticamente insignificantes en la calidad de vida relacionada con la salud.No se ha obtenido éxito en el tratamiento de los temblores y la ataxia relacionados con la EM y no se han demostrado cambios significativos en términos de discapacidad y progresión en los pacientes con EM. | Moderado con los efectos adversos más comúnmente reportados: mareos, fatiga, somnolencia, vértigo y boca seca. |
| Dronabinol | Altamente eficaz en el tratamiento del dolor en pacientes con EM.Mejora significativa en los problemas de sueño en pacientes con EM.Los demás síntomas mostraron poca mejoría o ningún efecto. | Efectos adversos leves a moderados: mareos, sequedad de boca y cansancio. |
| Nabilona | Efectos beneficiosos en la reducción de la mayoría de los síntomas de la EM, incluida la espasticidad, el dolor, la disfunción de la vejiga y la calidad de vida.No hay efectos significativos sobre los temblores.No hay ninguna investigación clínica sobre los síntomas de los problemas de sueño relacionados con la EM y la discapacidad y progresión relacionadas con la EM. | Efectos adversos leves a moderados: mareos, sequedad de boca, cansancio y astenia. |
2.1.1. Efectos de los nabiximols en la espasticidad relacionada con la EM
Wade y sus colegas informaron sobre un ensayo de extensión abierto en 2006 que incluyó a 137 pacientes diagnosticados con EM tras un estudio controlado con placebo de 6 semanas de duración. En este estudio, se evaluó la eficacia y la tolerabilidad de Sativex para el tratamiento de la espasticidad y otros síntomas durante aproximadamente 15 semanas [ 82 ]. El resultado principal se evaluó mediante una escala analógica visual, que reveló una reducción consistente de la espasticidad. Además, tuvo efectos desfavorables sobre el dolor, el temblor y los síntomas vesicales de la EM, y 58 pacientes abandonaron el estudio debido a su ineficacia [ 82 ].
Collin et al. realizaron un estudio doble ciego controlado con placebo de 6 semanas de duración con 189 pacientes en 2007, comparando los efectos de Sativex entre los grupos [ 83 ]. Se observó una diferencia significativa en la reducción de la espasticidad entre los grupos activo y placebo, con una disminución en la puntuación de la escala de calificación numérica (NRS) de p = 0,048 [ 83 ]. Sin embargo, como criterio de valoración secundario, no se observó un impacto terapéutico entre otras puntuaciones de Ashworth [ 83 ].
Novotna y sus colegas llevaron a cabo un gran ensayo multicéntrico de fase III en 2011 que incluyó dos fases de diseño del estudio: la fase A comenzó con un tratamiento simple ciego de cuatro semanas para identificar a los pacientes con respuesta temprana al aerosol oromucosal Nabixomols, seguida de la fase B, un estudio aleatorizado y doble ciego de 12 semanas [ 77 ]. La dosis diaria máxima recomendada de nabixomols fue de 12 aplicaciones. En un estudio que comparó el aerosol oromucosal con placebo, este último se asoció con una reducción del 51% en la espasticidad en la EM. Además, las puntuaciones de la NRS disminuyeron un 20% [ 77 ].
Con base en una serie de ensayos clínicos controlados aleatorios frente a placebo, se administraron y autorizaron los Nabiximols por su eficacia terapéutica y alivio de los síntomas relacionados con la espasticidad [ 56 , 79 , 83 ]. El estudio antiespástico de primera línea se diseñó e implementó recientemente utilizando una metodología de diseño enriquecido como prueba de la solicitud de la autoridad alemana de que los Nabixomols adicionales fueron más efectivos que reajustar el régimen de medicación antiespástica solo para brindar alivio sintomático de la espasticidad de la EM durante un período de prueba de 4 semanas en comparación con placebo [ 84 ]. SAVANT, una investigación bien diseñada de Nabixomol oromucosal como terapia adicional para el tratamiento de la espasticidad de la EM en pacientes con EM, encontró que tuvo un efecto prometedor en la reducción de los síntomas de espasticidad de moderados a severos [ 85 ].
Los nabiximols están aprobados y se recomiendan como tratamiento complementario para pacientes adultos con espasticidad por EM resistente de moderada a grave en varios países occidentales [ 86 , 87 ].
2.1.2. Efecto de los nabiximols sobre el dolor asociado con la EM
Nabiximols (spray oromucosal): una investigación aleatorizada, controlada con placebo en la que 66 pacientes fueron asignados aleatoriamente a Nabiximols o placebo encontró que Nabiximols fue eficaz para aliviar tanto el dolor central asociado con EM como la interrupción del sueño relacionada con el dolor [ 88 ]. En un experimento doble ciego diferente realizado en 2013, 339 pacientes con dolor neuropático central asociado con EM fueron asignados aleatoriamente a 167 Nabiximols y 172 placebos, y los Nabiximols mostraron una tasa de respuesta estadísticamente significativa en la semana 10 en comparación con el placebo [ 80 ]. Los autores explicaron los hallazgos afirmando que su población de pacientes puede representar un grupo particularmente resistente al tratamiento porque tenían dolor de larga duración que se extendía por más de 5 años en promedio, y demostraron que aquellos con un historial de dolor neuropático de menos de 4 años tenían más probabilidades de ser resistentes al tratamiento [ 80 ]. Nueve estudios controlados aleatorizados con 1289 personas se incluyeron en un metanálisis sistemático reciente sobre el espray oromucosal de THC y CBD y placebo para el tratamiento del dolor neuropático crónico. Se observó que los nabiximols alivian el dolor neuropático crónico con mayor eficacia que el placebo, con una magnitud del efecto pequeña [ 89 ]. Esto sugiere que podría ser muy interesante realizar más investigaciones sobre el potencial completo de los nabiximols en estas personas.
2.1.3. Efectos de los nabiximols sobre el temblor relacionado con la EM
Solo 13 de los individuos en un ensayo de Clase I usando los Nabiximols para ver si los extractos de cannabis tenían un efecto sobre los síntomas en la EM tenían un temblor como su síntoma predominante. La Escala Visual Analógica no cambió cuando se usó un aerosol oral (THC/CBD) a una dosis de 2.5/120 diariamente en dosis divididas. Debido al pequeño número de participantes, no se llegó a ninguna conclusión o diferencia [ 56 ]. Una investigación más reciente usó una escala de calificación numérica (NRS) de 0 a 10 para evaluar la gravedad de los síntomas de la EM en 337 pacientes tratados con Nabiximols, con un número indeterminado de pacientes que calificaron el temblor en la NRS, y no encontró diferencias entre Nabiximols y placebo [ 79 ]. Los Nabiximols fueron mencionados en una revisión sistemática publicada por Koppel et al. en 2014. Para tratar los temblores asociados con la EM, los Nabiximols fueron considerados "potencialmente ineficaces" [ 40 ]. Como resultado, parece que Nabiximols no tiene éxito en el tratamiento de los temblores y la ataxia relacionados con la EM.
2.1.4. Efecto de los nabiximols en la función vesical relacionada con la EM
El aerosol oromucosal de THC y CBD (Nabiximols) redujo la frecuencia de orina de nicturia y mejoró las medidas de calidad de vida relacionadas con la incontinencia en una investigación de clase 1 [ 90 ]. Se encontró que los nabiximols tenían un efecto menor en el alivio de las disfunciones de la vejiga en pacientes con EM [ 90 ].
El impacto de un extracto medicinal basado en cannabis en los síntomas de EM se estudió en 160 pacientes con EM en un estudio de clase 1, doble ciego, aleatorizado y controlado con placebo. Se investigó el efecto de Sativex en los síntomas de disfunción vesical en EM [ 56 ]. Estos grupos no experimentaron ninguna mejoría en las dificultades de la vejiga después de usar Sativex [ 56 ]. Otra investigación controlada aleatorizada [ 90 ] analizó la eficacia y seguridad de Sativex en el tratamiento de los síntomas de disfunción vesical en EM en 135 pacientes con EM. Sativex se utilizó para tratar los síntomas de EM de hiperactividad del detrusor como terapia complementaria [ 90 ]. El criterio de valoración principal de este ensayo paralelo, doble ciego, aleatorizado y controlado con placebo después de 10 semanas no reveló diferencias significativas entre Sativex y placebo en los episodios diarios medios de incontinencia ( p = 0,056) [ 90 ]. Se encontró que Sativex fue exitoso en cuatro criterios de valoración secundarios de siete, con una significancia de p = 0,00. Sativex parece tener algún efecto en la mejora de la disfunción vesical en pacientes con EM; sin embargo, el criterio de valoración principal no alcanzó significación estadística [ 90 ]. Giorgia et al. llevaron a cabo un ensayo prospectivo piloto en 2017 para examinar el efecto del aerosol oromucosal de THC/CBD en los síntomas de disfunción vesical en pacientes con EM. Se examinó a un total de 21 pacientes con EM, 15 de ellos recibieron una evaluación clínica detallada (estudios urodinámicos exhaustivos) antes y después de un mes de tratamiento oromucosal con THC/CBD [ 91 ]. Se informó que los síntomas de hiperactividad se redujeron ( p = 0,001), y se descubrió que la administración de un aerosol oromucosal era beneficiosa para tratar los síntomas de vejiga hiperactiva. El aerosol oromucosal de THC/CBD puede mejorar la vejiga hiperactiva en personas con síntomas resistentes a la EM, según un estudio [ 91 ].
2.1.5. Efectos de los nabiximols en los trastornos del sueño relacionados con la EM
Russo et al. realizaron una revisión del uso de Sativex para examinar los trastornos del sueño y descubrieron que hubo una mejoría del sueño sin tolerancia a la medicación [ 92 ]. Wade et al. evaluaron la eficacia de Nabixomols en 160 participantes en una investigación de grupos paralelos, doble ciego, aleatorizada y controlada con placebo en 2004 [ 56 ]. El ensayo duró 6 semanas, seguido de un período de extensión activa de 4 semanas. La administración de Nabixomols resultó en una mejoría considerable de las dificultades del sueño en este estudio [ 56 ]. En 2011, Novotna publicó los resultados de un ensayo fundamental de fase tres para Nabixomols, que reveló una mejoría significativa ( valor p 0,0001) en los problemas de sueño de la EM, que se consideraron un punto final secundario en el estudio [ 77 ].
2.1.6. Efectos de los nabiximols en la calidad de vida relacionada con la EM
Los efectos de Nabiximols en la CVRS específica de EM se estudiaron durante 3 a 4 meses en la investigación MOVE 2 [ 93 ]. Aunque el ensayo MOVE 2 encontró un efecto beneficioso de Nabiximols en la CVRS física y mental, los investigadores no encontraron cambios en la CVRS en pacientes con EM cuando los evaluaron durante un año utilizando el mismo método que el estudio MOVE 2 [ 93 , 94 ]. En total, 337 pacientes con EM fueron evaluados en un ensayo controlado aleatorio de 15 semanas que informó algunos efectos favorables pero estadísticamente insignificantes en la CVRS con la terapia con Nabiximols [ 79 ]. Otro ensayo de 19 semanas que trató a 241 pacientes con EM con Nabiximols reveló mejoras insignificantes similares en la CVRS [ 77 ].
2.1.7. Efectos de Nabiximols sobre la discapacidad relacionada con la EM y su progresión
En términos de discapacidad y progresión, las evaluaciones no encontraron cambios significativos en varios índices, como el índice de Barthel de actividad de la vida diaria y el tiempo de caminata de la discapacidad de EM [ 56 , 63 , 95 ]. El experimento CUPID evaluó el impacto y la seguridad del cannabis oral THC para retrasar la enfermedad cerebral inflamatoria progresiva en pacientes con EM (CUPID) [ 96 ]. Fue un ensayo aleatorizado, doble ciego, controlado con placebo, de grupos paralelos y multicéntrico. Un total de 498 participantes fueron aleatorizados (332 a activos y 166 a placebo) y 493 (329 activos y 164 placebos) fueron examinados en este estudio. A los pacientes se les administró (9)-THC o placebo en una proporción de 2:1. No hubo un impacto significativo del tratamiento en los resultados primarios o secundarios. Además, no hubo problemas de seguridad sustanciales, pero los efectos secundarios desfavorables parecieron tener un impacto en el cumplimiento [ 96 ].
2.2. Dronabinol
El isómero principal del THC presente en la planta de cannabis, (−)-trans-9-THC(Dronabinol(d), Figura 1 ), se conoce con el nombre genérico Dronabinol. El dronabinol está disponible en tres formulaciones de concentración: cápsula oral de gelatina blanda, cápsula oral de gelatina blanda y cápsula oral de gelatina blanda (2,5, 5 y 10 mg). Se utilizó por primera vez para tratar los vómitos y las náuseas inducidos por la quimioterapia, así como la anorexia y la pérdida de peso en pacientes con SIDA, y se probó en diez ensayos clínicos por su eficacia y seguridad en el tratamiento de los síntomas de la EM, incluyendo espasticidad, dolor, temblor, función de la vejiga, sueño, calidad de vida y efectos secundarios [ 57 , 97 , 98 , 99 , 100 , 101 , 102 , 103 , 104 , 105 ]. El dronabinol parece ser muy eficaz en el tratamiento del dolor en pacientes con EM, según la mayor parte de la evidencia clínica, aunque otros síntomas mostraron solo poca mejoría ( Tabla 1 ) [ 95 ].
2.2.1. Efectos del dronabinol en la espasticidad relacionada con la EM
Zajick et al. llevaron a cabo una investigación multicéntrica, aleatorizada y controlada con placebo en 630 pacientes de 18 a 64 años en 2003 [ 57 ]. El efecto de Marinol (Dronabinol) y Cannador administrados por vía oral sobre los síntomas de EM se estudió durante 15 semanas en este estudio de diseño [ 57 ]. Se utilizó 0,25 mg/kg de 9-THC ajustado al peso (Dronabinol, suministrado por vía oral en cápsulas de 2,5 mg), aceite de Cannabis natural (Cannador) o placebo para proporcionar la dosis [ 57 ]. El estudio evaluó los efectos del extracto de cannabis administrado por vía oral (Cannador), Dronabinol o placebo sobre la espasticidad después de una fase de titulación de dosis de 28 días utilizando la escala de Ashworth. Durante un año, el 80% de los sujetos demostró una reducción moderada de la espasticidad [ 57 ]. No hubo un impacto terapéutico significativo entre los grupos activo y placebo en el resultado primario. En comparación con el grupo placebo, los grupos que tomaron dronabinol o Candor para la espasticidad mostraron una mayor mejoría en el resultado secundario. Descubrieron que los sujetos que tomaron dronabinol mostraron una ligera mejoría en la escala de Ashworth ( p = 0,003) después de 12 meses de seguimiento, lo cual no se detectó en los grupos de lata o placebo [ 57 ].
2.2.2. Efectos del dronabinol sobre el dolor asociado con la EM
Schimrigk et al. publicaron un estudio que demostró la superioridad del dronabinol frente al placebo en el tratamiento del dolor neuropático [ 106 ]. Descubrieron una diferencia clínicamente relevante entre los grupos de tratamiento y placebo, sin significación estadística. También descubrieron que es una opción segura para el tratamiento a largo plazo de la EM con dolor, ya que el número de efectos secundarios fue comparable al del tratamiento habitual [ 106 ].
2.2.3. Efectos del dronabinol sobre el temblor relacionado con la EM
A un total de 391 personas en el estudio CAMS se les administró THC (Dronabinol), THC/CBD o placebo por vía oral; sin embargo, no hubo una diferencia estadísticamente significativa en la reacción al temblor medida mediante una evaluación médica ( p = 0,052) o un autoinforme ( p = 0,398) [ 57 ].
2.2.4. Efectos del dronabinol en las funciones vesicales relacionadas con la EM
El ensayo CAMS [ 57 ] utilizó extracto oral de cannabis o (Dronabinol) THC para evaluar las molestias vesicales en 667 participantes con síntomas de EM como resultado secundario. No se observó mejoría en los síntomas vesicales de EM con el uso de Dronabinol o extracto oral de cannabis [ 57 ].
2.2.5. Efectos del dronabinol en los trastornos del sueño relacionados con la EM
El ensayo CAMS analizó los efectos de la marihuana en 630 pacientes con EM y espasticidad. Durante 15 semanas, los pacientes con EM se dividieron en cuatro grupos: Cannador oral, Dronabinol, Candor placebo o Dronabinol placebo [ 57 ]. En comparación con otros grupos placebo, el grupo de administración oral que tomó Candor o Dronabinol demostró una mejora significativa en los problemas de sueño de la EM [ 57 ]. Para evaluar el efecto del Dronabinol en las dificultades del sueño, se realizó un estudio de caso en mujeres de 52 años con EM. El Dronabinol se administró por vía oral en una dosis de 2,5 mg BID durante una semana antes de aumentarse a 5 mg BID. La paciente registró los resultados utilizando un análogo visual, concluyendo que la calidad del sueño mejoró durante el tratamiento [ 107 ].
2.2.6. Efectos del dronabinol en la calidad de vida relacionada con la EM
Un estudio cruzado de tres semanas que comparó el efecto del dronabinol sobre la calidad de vida relacionada con la salud en 24 pacientes con EM no encontró diferencias significativas en la calidad de vida relacionada con la salud en los pacientes tratados en comparación con el grupo placebo [ 100 ].
2.2.7. Efectos del dronabinol sobre la discapacidad relacionada con la EM y su progresión
El efecto del dronabinol sobre la progresión de la EM progresiva se estudió en un experimento aleatorizado, doble ciego, paralelo y controlado con placebo [ 105 ]. Durante 36 meses, se administró dronabinol a los pacientes en una dosis máxima diaria de 28 mg o placebo. En comparación con el grupo placebo, el 35 % del grupo de dronabinol experimentó al menos un evento adverso. En general, no se observaron problemas de seguridad ni efectos secundarios asociados con el uso de dronabinol para reducir la evolución de la EM [ 105 ].
2.3. Nabilona
Nabilona ( Figura 1 e) es el nombre genérico del principal análogo sintético del 9-THC, que presenta la estructura de dibenzopiran-9-ona con una combinación racémica de isómeros (S,S)-(+)- y (R,R)-(−). La nabilona se aprobó en 1985 para el tratamiento de los vómitos y las náuseas inducidos por la quimioterapia en personas que no respondían a los antieméticos estándar; sin embargo, los antagonistas del receptor 5-HT3 de la serotonina han sustituido parcialmente a la nabilona para este uso. La nabilona también está aprobada para el tratamiento del dolor neuropático y crónico por cáncer, así como para la espasticidad por EM. Se presenta en tres dosis en comprimidos (0,25, 0,5 y 1 mg). La efectividad de la nabilona en el tratamiento de la espasticidad de la EM se investigó en tres estudios clínicos publicados entre 1995 y 2015 [ 108 , 109 , 110 ] y se revisó en cuatro revisiones publicadas entre 2006 y 2015 [ 40 , 44 , 46 , 111 ]. La nabilona parece ser beneficiosa para reducir la mayoría de los síntomas de la EM, incluida la rigidez, el dolor, la disfunción de la vejiga y la calidad de vida, según la mayoría de los ensayos ( Tabla 1 ).
2.3.1. Efectos de la nabilona en la espasticidad relacionada con la EM
Martyan et al. estudiaron los efectos de la nabilona en la espasticidad relacionada con la EM durante cuatro semanas [ 108 ]. Sus hallazgos indicaron que los síntomas de espasticidad de la EM han mejorado [ 108 ]. Un metanálisis de tres grupos paralelos basado en el enfoque de calificación GRADE reveló que la nabilona tiene un efecto moderado en la espasticidad relacionada con la EM [ 75 ].
2.3.2. Efectos de la nabilona en el dolor relacionado con la EM
Un metaanálisis de ensayos clínicos aleatorizados halló evidencia suficiente para respaldar el impacto mejorado de la nabilona en el dolor asociado a la EM [ 75 ]. En 2015, un estudio aleatorizado doble ciego evaluó los efectos de la nabilona como tratamiento complementario a la gabapentina para el dolor neuropático causado por la EM recurrente-remitente. Se concluyó que la nabilona combinada con gabapentina es un tratamiento eficaz, novedoso y bien tolerado para pacientes con EM y dolor neuropático [ 110 ].
2.3.3. Efectos de la nabilona sobre el temblor relacionado con la EM
En un ensayo de clase III se demostró que la nabilona oral no tiene un efecto significativo sobre los temblores [ 55 ]. En una evaluación sistémica de 630 individuos, Koppel et al. concluyeron que la nabilona oral no afecta los temblores relacionados con la EM [ 40 ].
2.3.4. Efectos de la nabilona en la función vesical relacionada con la EM
Martyn et al. observaron un alivio significativo de los síntomas de disfunción vesical en pacientes con EM con nabilona oral durante dos períodos de cuatro semanas en una investigación doble ciego, cruzada y controlada con placebo [ 108 ].
2.3.5. Efectos de la nabilona en los trastornos del sueño relacionados con la EM
No hubo ninguna investigación clínica que demostrara la eficacia de Nabilone sobre los síntomas de los problemas de sueño de la EM [ 72 ].
2.3.6. Efectos de la nabilona en la calidad de vida relacionada con la EM
En 2015, un ensayo controlado aleatorio analizó la eficacia de combinar nabilona y gabapentina para el tratamiento del dolor neuropático relacionado con la EM [ 110 ]. Se descubrió que esta combinación mejoraba la calidad de vida de este grupo de personas [ 110 ].
2.3.7. Efectos de la nabilona sobre la discapacidad y la progresión de la misma en la EM
No hubo ninguna investigación clínica que indicara cómo la nabilona afectaba la discapacidad y la progresión relacionadas con la EM [ 72 ].
3. Efectos adversos
Varios estudios que emplearon cannabis en pacientes con EM informaron los efectos secundarios de los fármacos [ 72 , 82 , 112 , 113 ]. La gravedad de estos efectos secundarios se describió típicamente como "leve" a "moderada", dependiendo de una variedad de factores, como la dosis, el tipo y las cantidades de cannabinoides en los productos utilizados y los individuos [ 72 , 82 , 112 , 113 ]. Mareos/aturdimiento (14-59%), síntomas gastrointestinales (diarrea, náuseas y vómitos) (13-37% en grupos activos), boca seca (4-26% en grupos activos), infecciones del tracto urinario (15,4-34%) y otros efectos adversos, como fatiga, dolor de cabeza, alteración de la atención y desorientación, son los efectos adversos notificados con mayor frecuencia en pacientes con EM tratados con cannabinoides [ 56 , 57 , 77 , 112 ]. Un estudio reciente aprovechó la base de datos Epistemonikos y analizó 25 revisiones sistemáticas sobre el uso de cannabinoides en pacientes con EM; concluyeron que la relación beneficio-riesgo del uso de cannabinoides en estos pacientes es desfavorable, porque hay un alto nivel de evidencia sobre la falta de beneficios y los efectos adversos son comunes [ 114 ]. La mayoría de las evaluaciones de estos estudios no encontraron evidencia de que alguno de estos efectos secundarios limite el uso clínico [ 72 ].
3.1. Nabiximoles
En una investigación de clase I, 268 (46,9%) de 572 pacientes tratados con Nabiximols informaron al menos un efecto secundario, los más frecuentes fueron mareos y cansancio [ 77 ]. La tolerabilidad de Nabiximols se evaluó en 325 pacientes en la investigación MOVE 2, con mareos, fatiga, somnolencia, náuseas y sequedad de boca informados en el 16,6% de los pacientes (54 de 325 individuos) durante tres meses [ 93 ]. La mayoría de estos efectos secundarios (47 pacientes) fueron modestos; sin embargo, hubo efectos secundarios significativos asociados con Nabiximols, incluyendo desesperación, capacidad reducida para caminar, espasmos musculares e infección del tracto urinario [ 93 ]. En el 11,4% de los casos, se suspendió el medicamento (37 sujetos que experimentaron efectos adversos durante el período de estudio). El estudio lo clasificó como bien tolerado [ 93 ]. En otro estudio [ 115 ], se encontró que los nabiximols empeoraban el control del equilibrio en pacientes con EM , particularmente en condiciones de multitarea; sin embargo, un estudio reciente encontró que los nabiximols tenían un efecto favorable a corto plazo en el equilibrio y la capacidad de caminar en pacientes con EM [ 116 ]. En un ensayo de cohorte reciente con 396 pacientes con EM a quienes se les administró nabiximols, 63 pacientes abandonaron debido a problemas de tolerancia y seguridad. Los efectos secundarios notificados con mayor frecuencia fueron somnolencia (5,2%), vértigo/mareos (4,8%) y cansancio (3,8%). A pesar de esto, no se observaron efectos secundarios importantes durante las etapas de titulación y tratamiento del ensayo [ 117 ].
3.2. Cannabinoides orales y THC
La mayoría de los efectos secundarios fueron leves a moderados y dependientes de la dosis, según un informe de revisión que abarcó múltiples ensayos clínicos de CBD/THC en pacientes con EM [ 46 ]. Indicaron que se necesitaban al menos 10 mg de THC para tratar la espasticidad; sin embargo, se identificaron efectos nocivos en dosis de 15 mg y superiores [ 46 ].
Aunque algunos estudios han descubierto que la combinación de THC y CBD por vía oral causa significativamente más efectos negativos [ 63 , 97 ], otros han descubierto que la combinación de THC y CBD causa menos efectos negativos [ 57 , 118 ]. Un total de 144 pacientes con EM fueron tratados con THC y CBD por vía oral (titulados a una dosis máxima de 25 mg de THC al día) en una investigación de clase I, mientras que a 135 se les administró un placebo [ 112 ]. Los efectos adversos hicieron que 30 de los 144 pacientes del grupo de control abandonaran el tratamiento, mientras que los efectos adversos hicieron que 9 de los 135 pacientes del grupo placebo abandonaran el tratamiento [ 112 ]. Mareos, sequedad de boca, cansancio, infección del tracto urinario, astenia y dolor de cabeza fueron los efectos adversos notificados con mayor frecuencia en el grupo de extracto de cannabis, y todos se clasificaron como leves a moderados [ 112 ]. En una evaluación de metanálisis de la tolerabilidad de los cannabinoides en pacientes con EM, los grupos de tratamiento activo con dronabinol y cannabinoides, pero no con nabilona, tuvieron una mayor probabilidad de retiro de los estudios debido a efectos desagradables [ 119 ]. Mareos, sequedad de boca y cansancio fueron los síntomas secundarios notificados con mayor frecuencia [ 119 ].
4. Conclusiones
Este estudio analiza el impacto de diversas vías de administración de cannabis en pacientes con EM con diversos síntomas. Se encontraron indicios de que el cannabis potencia la eficacia de los cannabinoides, concretamente mediante pulverización oromucosal y por vía oral, en el tratamiento del dolor y la espasticidad, que son los síntomas más comunes en pacientes con EM. En general, los efectos adversos fueron de leves a moderados, aunque se debe prestar especial atención a los pacientes con esclerosis múltiple.
Abreviaturas
| CBD | cannabidiol |
| C. Sativa | Cannabis sativa |
| GPCR | Receptores acoplados a proteína G |
| CVRS | Calidad de vida relacionada con la salud |
| EM | esclerosis múltiple |
| NRS | escala de calificación numérica |
| THC | Δ9-tetrahidrocannabinol |
Contribuciones del autor
FH y GD revisaron la bibliografía y redactaron el primer borrador. RK redactó el borrador final y la versión revisada. Todos los autores leyeron y aprobaron la versión publicada del manuscrito.
Conflictos de intereses
Los autores declaran no tener ningún conflicto de intereses.
Declaración de financiación
Esta investigación no recibió financiación externa.
Notas al pie
Nota del editor: MDPI se mantiene neutral con respecto a los reclamos jurisdiccionales en los mapas publicados y las afiliaciones institucionales.
Referencias
- 1.Trapp DB, Nave K.-A. Esclerosis múltiple: ¿Un trastorno inmunitario o neurodegenerativo? Annu. Rev. Neurosci. 2008;31:247–269. doi: 10.1146/annurev.neuro.30.051606.094313. [ DOI ] [ PubMed ] [ Google Académico ]
- 2.Schwab N., Schneider-Hohendorf T., Wiendl H. Usos terapéuticos de los anticuerpos anti-α4-integrina (anti-VLA-4) en la esclerosis múltiple. Int. Immunol. 2015;27:47–53. doi: 10.1093/intimm/dxu096. [ DOI ] [ PubMed ] [ Google Académico ]
- 3.Rice GP, Incorvaia B., Munari LM, Ebers G., Polman C., D'Amico R., Parmelli E., Filippini G. Interferón en la esclerosis múltiple recurrente-remitente. Cochrane Database Syst. Rev. 2001;2001:CD002002. doi: 10.1002/14651858.CD002002. [ DOI ] [ Artículo gratuito de PMC ] [ PubMed ] [ Google Académico ]
- 4.Kraft GH, Freal JE, Coryell JK. Discapacidad, duración de la enfermedad y necesidades de servicios de rehabilitación en la esclerosis múltiple: Perspectivas del paciente. Arch. Phys. Med. Rehabil. 1986;67:164–168. doi: 10.1016/0003-9993(86)90060-2. [ DOI ] [ PubMed ] [ Google Académico ]
- 5.Breijyeh Z., Jubeh B., Bufo S., Karaman R., Scrano L. Cannabis: Una planta productora de toxinas con posibles usos terapéuticos. Toxins. 2021;13:117. doi: 10.3390/toxins13020117. [ DOI ] [ Artículo gratuito de PMC ] [ PubMed ] [ Google Académico ]
- 6.Bonini SA, Premoli M., Tambaro S., Kumar A., Maccarinelli G., Memo M., Mastinu A. Cannabis sativa: una revisión etnofarmacológica integral de una planta medicinal con una larga historia. J. Etnofarmacol. 2018;227:300–315. doi: 10.1016/j.jep.2018.09.004. [ DOI ] [ PubMed ] [ Google Scholar ]
- 7.Urits I., Borchart M., Hasegawa M., Kochanski J., Orhurhu V., Viswanath O. Actualización de los fármacos actuales a base de cannabis en la medicina del dolor. Pain Ther. 2019;8:41–51. doi: 10.1007/s40122-019-0114-4. [ DOI ] [ Artículo gratuito de PMC ] [ PubMed ] [ Google Académico ]
- 8.Brunt TM, van Genugten M., Höner-Snoeken K., van de Velde MJ, Niesink RJ Satisfacción terapéutica y efectos subjetivos de diferentes cepas de cannabis de calidad farmacéutica. J.Clin. Psicofarmacol. 2014;34:344–349. doi: 10.1097/JCP.0000000000000129. [ DOI ] [ PubMed ] [ Google Scholar ]
- 9.Kumar R., Chambers W., Pertwee R. Acciones farmacológicas y usos terapéuticos del cannabis y los cannabinoides. Anestesia. 2001;56:1059–1068. doi: 10.1046/j.1365-2044.2001.02269.x. [ DOI ] [ PubMed ] [ Google Académico ]
- 10.Hillig KW, Mahlberg PG. Análisis quimiotaxonómico de la variación de cannabinoides en Cannabis (Cannabaceae). Am. J. Bot. 2004;91:966–975. doi: 10.3732/ajb.91.6.966. [ DOI ] [ PubMed ] [ Google Académico ]
- 11.Pearce DD, Mitsouras K., Irizarry KJ. Discriminación de los efectos de Cannabis sativa y Cannabis indica: Una encuesta web a usuarios de cannabis medicinal. J. Altern. Complementary Med. 2014;20:787–791. doi: 10.1089/acm.2013.0190. [ DOI ] [ PubMed ] [ Google Académico ]
- 12.Rudroff T., Honce JM. Cannabis y esclerosis múltiple: El camino a seguir. Front. Neurol. 2017;8:299. doi: 10.3389/fneur.2017.00299. [ DOI ] [ Artículo gratuito de PMC ] [ PubMed ] [ Google Académico ]
- 13.Andre CM, Hausman J.-F., Guerriero G. Cannabis sativa: La planta de las mil y una moléculas. Portada. Plant Sci. 2016;7:19. doi: 10.3389/fpls.2016.00019. [ DOI ] [ Artículo gratuito de PMC ] [ PubMed ] [ Google Académico ]
- 14.Howlett AC, Barth F., Bonner TI, Cabral G., Casellas P. Unión Internacional de Farmacología. XXVII. Clasificación de los receptores cannabinoides. Pharmacol. Rev. 2002;54:161–202. doi: 10.1124/pr.54.2.161. [ DOI ] [ PubMed ] [ Google Académico ]
- 15.Pertwee R. Farmacología de los receptores cannabinoides CB1 y CB2. Pharmacol. Ther. 1997;74:129–180. doi: 10.1016/S0163-7258(97)82001-3. [ DOI ] [ PubMed ] [ Google Académico ]
- dieciséis.Ingram G., Pearson, OR Cannabis y esclerosis múltiple. Pract. Neurol. 2019;19:310–315. doi: 10.1136/practneurol-2018-002137. [ DOI ] [ PubMed ] [ Google Académico ]
- 17.Pertwee RG: Receptores cannabinoides y dolor. Prog. Neurobiol. 2001;63:569–611. doi: 10.1016/S0301-0082(00)00031-9. [ DOI ] [ PubMed ] [ Google Académico ]
- 18.Russo EB Controlando el THC: Posible sinergia del cannabis y efectos de séquito fitocannabinoides-terpenoides. Br. J. Pharmacol. 2011;163:1344–1364. doi: 10.1111/j.1476-5381.2011.01238.x. [ DOI ] [ Artículo gratuito de PMC ] [ PubMed ] [ Google Académico ]
- 19.ElSohly MA, Radwan MM, Gul W., Chandra S., Galal A. Fitoquímica de Cannabis sativa L. Fitocannabinoides. 2017;103:1–36. doi: 10.1007/978-3-319-45541-9_1. [ DOI ] [ PubMed ] [ Google Académico ]
- 20.Citti C., Linciano P., Russo F., Luongo L., Iannotta M., Maione S., Laganà A., Capriotti AL, Forni F., Vandelli MA, et al. Un nuevo fitocannabinoide aislado de Cannabis sativa L. con una actividad cannabimimética in vivo superior al Δ9-tetrahidrocannabinol: Δ9-Tetrahidrocannabiforol. Ciencia. Rep. 2019;9:1–13. doi: 10.1038/s41598-019-56785-1. [ DOI ] [ Artículo gratuito de PMC ] [ PubMed ] [ Google Scholar ]
- 21.Ożarowski M., Karpiński T., Zielińska A., Souto E., Wielgus K. Cannabidiol en enfermedades neurológicas y neoplásicas: últimos avances sobre el mecanismo de acción molecular. Int. J. Mol. Ciencia. 2021;22:4294. doi: 10.3390/ijms22094294. [ DOI ] [ Artículo gratuito de PMC ] [ PubMed ] [ Google Scholar ]
- 22.Fischedick JT. Identificación de quimiotipos terpenoides en cultivares de Cannabis sativa L. con alta producción de (−)-trans-Δ9-tetrahidrocannabinol. Cannabis Cannabinoid Res. 2017;2:34–47. doi: 10.1089/can.2016.0040. [ DOI ] [ Artículo gratuito de PMC ] [ PubMed ] [ Google Académico ]
- 23.VanDolah HJ, Bauer BA, Mauck KF. Guía clínica sobre cannabidiol y aceites de cáñamo. Mayo Clin. Proc. 2019;94:1840–1851. doi: 10.1016/j.mayocp.2019.01.003. [ DOI ] [ PubMed ] [ Google Académico ]
- 24.Pertwee RG: Estrategias emergentes para el aprovechamiento de los agonistas de los receptores cannabinoides como fármacos. Br. J. Pharmacol. 2009;156:397–411. doi: 10.1111/j.1476-5381.2008.00048.x. [ DOI ] [ Artículo gratuito de PMC ] [ PubMed ] [ Google Académico ]
- 25.Kreitzer AC, Regehr WG. Señalización retrógrada por endocannabinoides. Curr. Opin. Neurobiol. 2002;12:324–330. doi: 10.1016/S0959-4388(02)00328-8. [ DOI ] [ PubMed ] [ Google Académico ]
- 26.Alger BE Señalización retrógrada en la regulación de la transmisión sináptica: Enfoque en los endocannabinoides. Prog. Neurobiol. 2002;68:247–286. doi: 10.1016/S0301-0082(02)00080-1. [ DOI ] [ PubMed ] [ Google Académico ]
- 27.Rudroff T., Sosnoff J. Cannabidiol para mejorar la movilidad en personas con esclerosis múltiple. Portada. Neurol. 2018;9:183. doi: 10.3389/fneur.2018.00183. [ DOI ] [ Artículo gratuito de PMC ] [ PubMed ] [ Google Académico ]
- 28.Zwibel HL: Contribución de la movilidad reducida y los síntomas generales a la carga de la esclerosis múltiple. Adv. Ther. 2009;26:1043–1057. doi: 10.1007/s12325-009-0082-x. [ DOI ] [ PubMed ] [ Google Académico ]
- 29.Jensen CJ, Stankovich J., Van Der Walt A., Bahlo M., Taylor BV, van der Mei I., Foote S., Kilpatrick T., Johnson LJ, Wilkins E., et al. Los SNP asociados a la susceptibilidad a la esclerosis múltiple no influyen en las medidas de gravedad de la enfermedad en una cohorte de pacientes australianos con EM. PLoS ONE. 2010;5:e10003. doi: 10.1371/journal.pone.0010003. [ DOI ] [ Artículo gratuito de PMC ] [ PubMed ] [ Google Académico ]
- 30.Briggs FBS, Shao X., A Goldstein B., Oksenberg JR, Barcellos LF, De Jager PL, Consorcio Internacional de Genética de la Esclerosis Múltiple. Estudio de asociación genómica de la gravedad de la esclerosis múltiple. Genes Immun. 2011;12:615–625. doi: 10.1038/gene.2011.34. [ DOI ] [ Artículo gratuito de PMC ] [ PubMed ] [ Google Académico ]
- 31.Furgiuele A., Cosentino M., Ferrari M., Marino F. Potencial inmunomodulador del cannabidiol en la esclerosis múltiple: Una revisión sistemática. J. Neuroimmune Pharmacol. 2021;16:251–269. doi: 10.1007/s11481-021-09982-7. [ DOI ] [ Artículo gratuito de PMC ] [ PubMed ] [ Google Académico ]
- 32.Hugos CL, Cameron MH. Evaluación y medición de la espasticidad en la EM: Estado de la evidencia. Curr. Neurol. Neurosci. Rep. 2019;19:1–7. doi: 10.1007/s11910-019-0991-2. [ DOI ] [ Artículo gratuito de PMC ] [ PubMed ] [ Google Académico ]
- 33.Rizzo MA, Hadjimichael OC, Preiningerova JL, Vollmer TL. Prevalencia y tratamiento de la espasticidad reportados por pacientes con esclerosis múltiple. Mult. Scler. J. 2004;10:589–595. doi: 10.1191/1352458504ms1085oa. [ DOI ] [ PubMed ] [ Google Académico ]
- 34.Milinis K., Tennant A., Young C. Espasticidad en la esclerosis múltiple: Asociaciones con discapacidades y calidad de vida general. Trastornos Relacionados con la Esclerosis Múltiple. 2016;5:34–39. doi: 10.1016/j.msard.2015.10.007. [ DOI ] [ PubMed ] [ Google Académico ]
- 35.Biering-Sørensen F., Nielsen JB, Klinge K. Evaluación de la espasticidad: una revisión. Médula espinal. 2006;44:708–722. doi: 10.1038/sj.sc.3101928. [ DOI ] [ PubMed ] [ Google Scholar ]
- 36.Haselkorn JK, Richer CB, Welch DF, Herndon RM, Johnson B., Little JW, Miller JR, Rosenberg JH, E Seidle M., Directrices MSCFCP: Resumen del manejo de la espasticidad en la esclerosis múltiple. Estrategias de manejo basadas en la evidencia para el tratamiento de la espasticidad en la esclerosis múltiple. J. Spinal Cord Med. 2005;28:167–199. doi: 10.1080/10790268.2005.11754545. [ DOI ] [ PubMed ] [ Google Académico ]
- 37.Flachenecker P., Henze T., Zettl UK. Espasticidad en pacientes con esclerosis múltiple: características clínicas, tratamiento y calidad de vida. Acta Neurol. Scand. 2014;129:154–162. doi: 10.1111/ane.12202. [ DOI ] [ PubMed ] [ Google Académico ]
- 38.Lapeyre E., Kuks JB, Meijler WJ Espasticidad: Reconsiderando el papel y el valor individual de varios tratamientos farmacológicos. NeuroRehabilitación. 2010;27:193–200. doi: 10.3233/NRE-2010-0596. [ DOI ] [ PubMed ] [ Google Académico ]
- 39.Halpern R., Gillard P., Graham GD, Varon SF, Zorowitz RD. Adherencia asociada a la medicación oral en el tratamiento de la espasticidad. PMR. 2013;5:747–756. doi: 10.1016/j.pmrj.2013.04.022. [ DOI ] [ PubMed ] [ Google Académico ]
- 40.Koppel BS, Brust JC, Fife T., Bronstein J., Youssof S., Gronseth G., Gloss D. Revisión sistemática: Eficacia y seguridad de la marihuana medicinal en trastornos neurológicos seleccionados: Informe del Subcomité de Desarrollo de Guías de la Academia Americana de Neurología. Neurología. 2014;82:1556–1563. doi: 10.1212/WNL.0000000000000363. [ DOI ] [ Artículo gratuito de PMC ] [ PubMed ] [ Google Académico ]
- 41.Yadav V., Bever C., Bowen J., Bowling A., Weinstock-Guttman B., Cameron M., Bourdette D., Gronseth GS, Narayanaswami P. Resumen de la guía basada en la evidencia: Medicina complementaria y alternativa en la esclerosis múltiple: Informe del subcomité de desarrollo de guías de la Academia Americana de Neurología. Neurología. 2014;82:1083–1092. doi: 10.1212/WNL.0000000000000250. [ DOI ] [ Artículo gratuito de PMC ] [ PubMed ] [ Google Académico ]
- 42.Chong MS, Wolff K., Wise K., Tanton C., Winstock A., Silber E. Consumo de cannabis en pacientes con esclerosis múltiple. Mult. Scler. J. 2006;12:646–651. doi: 10.1177/1352458506070947. [ DOI ] [ PubMed ] [ Google Académico ]
- 43.Ware M., Adams H., Guy G. El uso medicinal del cannabis en el Reino Unido: Resultados de una encuesta nacional. Int. J. Clin. Pract. 2005;59:291–295. doi: 10.1111/j.1742-1241.2004.00271.x. [ DOI ] [ PubMed ] [ Google Académico ]
- 44.Amar MB Cannabinoides en medicina: Una revisión de su potencial terapéutico. J. Ethnopharmacol. 2006;105:1–25. doi: 10.1016/j.jep.2006.02.001. [ DOI ] [ PubMed ] [ Google Académico ]
- 45.Lakhan SE, Rowland M. Extractos de cannabis de planta entera en el tratamiento de la espasticidad en la esclerosis múltiple: Una revisión sistemática. BMC Neurol. 2009;9:1–6. doi: 10.1186/1471-2377-9-59. [ DOI ] [ Artículo gratuito de PMC ] [ PubMed ] [ Google Académico ]
- 46.Karst M., Wippermann S., Ahrens J., Karst M. Rol de los cannabinoides en el tratamiento del dolor y la espasticidad (dolorosa). Drugs. 2010;70:2409–2438. doi: 10.2165/11585260-000000000-00000. [ DOI ] [ PubMed ] [ Google Académico ]
- 47.Hadjimichael O., Kerns RD, Rizzo MA, Cutter G., Vollmer T. Dolor persistente y sensaciones incómodas en personas con esclerosis múltiple. Pain. 2007;127:35–41. doi: 10.1016/j.pain.2006.07.015. [ DOI ] [ PubMed ] [ Google Académico ]
- 48.Forbes A., While A., Mathes L., Griffiths P. Problemas de salud y calidad de vida relacionada con la salud en personas con esclerosis múltiple. Clin. Rehabil. 2006;20:67–78. doi: 10.1191/0269215506cr880oa. [ DOI ] [ PubMed ] [ Google Académico ]
- 49.O'Connor AB, Schwid SR, Herrmann DN, Markman JD, Dworkin RH. Dolor asociado con la esclerosis múltiple: Revisión sistemática y propuesta de clasificación. PAIN. 2008;137:96–111. doi: 10.1016/j.pain.2007.08.024. [ DOI ] [ PubMed ] [ Google Académico ]
- 50.Iskedjian M., Bereza B., Gordon A., Piwko C., Einarson TR. Metaanálisis de tratamientos basados en cannabis para el dolor neuropático y relacionado con la esclerosis múltiple. Curr. Med. Res. Opin. 2007;23:17–24. doi: 10.1185/030079906X158066. [ DOI ] [ PubMed ] [ Google Académico ]
- 51.Solaro C., Lunardi GL, Mancardi GL Pain and MS. Int. MS J. 2003;10:14–19. [ PubMed ] [ Google Académico ]
- 52.Wilkins A. Disfunción cerebelosa en la esclerosis múltiple. Portada. Neurol. 2017;8:312. doi: 10.3389/fneur.2017.00312. [ DOI ] [ Artículo gratuito de PMC ] [ PubMed ] [ Google Académico ]
- 53.Swingler R., Compston D. La morbilidad de la esclerosis múltiple. QJM Int. J. Med. 1992;83:325–337. [ PubMed ] [ Google Académico ]
- 54.Mills RJ, Yap L., Young CA. Tratamiento de la ataxia en la esclerosis múltiple. Cochrane Database Syst. Rev. 2007;1:CD005029. doi: 10.1002/14651858.CD005029.pub2. [ DOI ] [ PubMed ] [ Google Académico ]
- 55.Fox SH, Kellett M., Moore AP, Crossman AR, Brotchie J. Ensayo aleatorizado, doble ciego, controlado con placebo para evaluar el potencial de la estimulación del receptor cannabinoide en el tratamiento de la distonía. Mov. Disord. 2002;17:145–149. doi: 10.1002/mds.1280. [ DOI ] [ PubMed ] [ Google Académico ]
- 56.Wade DT, Makela P., Robson P., House H., Bateman C. ¿Tienen los extractos medicinales de cannabis efectos generales o específicos sobre los síntomas de la esclerosis múltiple? Un estudio doble ciego, aleatorizado y controlado con placebo en 160 pacientes. Mult. Scler. J. 2004;10:434–441. doi: 10.1191/1352458504ms1082oa. [ DOI ] [ PubMed ] [ Google Académico ]
- 57.Zajicek J., Fox P., Sanders H., Wright D., Vickery J., Nunn A., Thompson A. Cannabinoides para el tratamiento de la espasticidad y otros síntomas relacionados con la esclerosis múltiple (estudio CAMS): Ensayo multicéntrico aleatorizado y controlado con placebo. Lancet. 2003;362:1517–1526. doi: 10.1016/S0140-6736(03)14738-1. [ DOI ] [ PubMed ] [ Google Académico ]
- 58.De Sèze M., Ruffion A., Denys P., Joseph P.-A., Perrouin-Verbe B., Grupo Internacional de Estudio de Expertos en Neurourología Francófona (GENULF). Vejiga neurogénica en la esclerosis múltiple: Revisión de la literatura y propuesta de guías de tratamiento. Mult. Scler. J. 2007;13:915–928. doi: 10.1177/1352458506075651. [ DOI ] [ PubMed ] [ Google Académico ]
- 59.Gallien P., Robineau S., Nicolas B., Le Bot M.-P., Brissot R., Verin M. Disfunción vesicouretral y hallazgos urodinámicos en la esclerosis múltiple: Un estudio de 149 casos. J. Urol. 1999;161:2032–2033. doi: 10.1016/S0022-5347(05)68896-9. [ DOI ] [ PubMed ] [ Google Académico ]
- 60.Giannantoni A., Scivoletto G., Di Stasi SM, Grasso MG, Vespasiani G., Castellano V. Disfunciones urológicas y afectación del tracto urinario superior en pacientes con esclerosis múltiple. Neurourol. Urodyn. Off. J. Int. Cont. Soc. 1998;17:89–98. doi: 10.1002/(SICI)1520-6777(1998)17:2-89::AID-NAU2-3.0.CO;2-8. [ DOI ] [ PubMed ] [ Google Académico ]
- 61.Koldewijn EL, Hommes OR, Lemmens WAJG, Debruyne FMJ, Van Kerrebroeck PEV Relación entre las anomalías del tracto urinario inferior y los parámetros relacionados con la enfermedad en la esclerosis múltiple. J. Urol. 1995;154:169–173. doi: 10.1016/S0022-5347(01)67258-6. [ DOI ] [ PubMed ] [ Google Scholar ]
- 62.Andersson K.-E. Fármacos actuales y futuros para el tratamiento de la disfunción vesical asociada a la EM. Ann. Phys. Rehabil. Med. 2014;57:321–328. doi: 10.1016/j.rehab.2014.05.009. [ DOI ] [ PubMed ] [ Google Académico ]
- 63.Zhornitsky S., Potvin S. Cannabidiol en humanos: La búsqueda de dianas terapéuticas. Pharmaceuticals. 2012;5:529–552. doi: 10.3390/ph5050529. [ DOI ] [ Artículo gratuito de PMC ] [ PubMed ] [ Google Académico ]
- 64.Merlino G., Fratticci L., Lenchig C., Valente M., Cargnelutti D., Picello M., Serafini A., Dolso P., Gigli G. Prevalencia de «sueño deficiente» en pacientes con esclerosis múltiple: Un predictor independiente del estado mental y físico. Sleep Med. 2009;10:26–34. doi: 10.1016/j.sleep.2007.11.004. [ DOI ] [ PubMed ] [ Google Académico ]
- 65.Brass SD, Duquette P., Proulx-Therrien J., Auerbach S. Trastornos del sueño en pacientes con esclerosis múltiple. Sleep Med. Rev. 2010;14:121–129. doi: 10.1016/j.smrv.2009.07.005. [ DOI ] [ PubMed ] [ Google Académico ]
- 66.Crayton H., Heyman RA, Rossman HS. Un enfoque multimodal para el manejo de los síntomas de la esclerosis múltiple. Neurología. 2004;63:S12–S18. doi: 10.1212/WNL.63.11_suppl_5.S12. [ DOI ] [ PubMed ] [ Google Académico ]
- 67.Attarian H. Importancia del sueño en la calidad de vida de los pacientes con esclerosis múltiple: Un problema poco reconocido desde hace tiempo. Sleep Med. 2008;10:7–8. doi: 10.1016/j.sleep.2008.02.002. [ DOI ] [ PubMed ] [ Google Scholar ]
- 68.Kaminska M., Kimoff RJ, Benedetti A., Robinson A., Bar-Or A., Lapierre Y., Schwartzman K., A. Trojan D. La apnea obstructiva del sueño se asocia con fatiga en la esclerosis múltiple. Mult. Scler. J. 2012;18:1159–1169. doi: 10.1177/1352458511432328. [ DOI ] [ PubMed ] [ Google Académico ]
- 69.Grupo W. Evaluación de la calidad de vida de la Organización Mundial de la Salud: Documento de posición de la Organización Mundial de la Salud. Soc. Sci. Med. 1995;41:1403–1409. doi: 10.1016/0277-9536(95)00112-k. [ DOI ] [ PubMed ] [ Google Académico ]
- 70.Amtmann D., Bamer AM, Kim J., Chung H., Salem R. Las personas con esclerosis múltiple reportan síntomas y una calidad de vida relacionada con la salud significativamente peores que la población general estadounidense, según las mediciones de resultados de PROMIS y NeuroQoL. Disabil. Health J. 2018;11:99–107. doi: 10.1016/j.dhjo.2017.04.008. [ DOI ] [ PubMed ] [ Google Académico ]
- 71.McCabe MP, McKern S. Calidad de vida y esclerosis múltiple: Comparación entre personas con esclerosis múltiple y la población general. J. Clin. Psychol. Med. Settings. 2002;9:287–295. doi: 10.1023/A:1020734901150. [ DOI ] [ Google Académico ]
- 72.Nielsen S., Germanos R., Weier M., Pollard J., Degenhardt L., Hall W., Buckley N., Farrell M. El uso de cannabis y cannabinoides en el tratamiento de los síntomas de la esclerosis múltiple: Una revisión sistemática de revisiones. Curr. Neurol. Neurosci. Rep. 2018;18:1–12. doi: 10.1007/s11910-018-0814-x. [ DOI ] [ PubMed ] [ Google Académico ]
- 73.Gunnarsson M., Malmeström C., Axelsson M., Sundström P., Dahle C., Vrethem M., Olsson T., Piehl F., Norgren N., Rosengren L., et al. El daño axonal en la esclerosis múltiple recidivante se reduce notablemente con natalizumab. Ann. Neurol. 2011;69:83–89. doi: 10.1002/ana.22247. [ DOI ] [ PubMed ] [ Google Académico ]
- 74.Marta M., Giovannoni G. Fármacos modificadores de la enfermedad en la esclerosis múltiple: Mecanismos de acción y nuevos fármacos en el horizonte. CNS Neurol. Disord. Drug Targets. 2012;11:610–623. doi: 10.2174/187152712801661301. [ DOI ] [ PubMed ] [ Google Académico ]
- 75.Whiting PF, Wolff RF, Deshpande S., di Nisio M., Duffy S., Hernandez AV, Keurentjes JC, Lang S., Misso K., Ryder S., et al. Cannabinoides para uso médico: Una revisión sistemática y metanálisis. JAMA. 2015;313:2456–2473. doi: 10.1001/jama.2015.6358. [ DOI ] [ PubMed ] [ Google Académico ]
- 76.Vermersch P. Sativex® (tetrahidrocannabinol + cannabidiol), un modulador del sistema endocannabinoide: Características básicas y principales datos clínicos. Expert Rev. Neurother. 2011;11:15–19. doi: 10.1586/ern.11.27. [ DOI ] [ PubMed ] [ Google Académico ]
- 77.Novotna A., Mares J., Ratcliffe S., Novakova I., Vachova M., Zapletalova O., Gasperini C., Pozzilli C., Cefaro L., Comi G., et al. Estudio aleatorizado, doble ciego, controlado con placebo, de grupos paralelos y con diseño enriquecido de nabiximols* (Sativex®), como terapia complementaria, en sujetos con espasticidad refractaria causada por esclerosis múltiple. Eur. J. Neurol. 2011;18:1122–1131. doi: 10.1111/j.1468-1331.2010.03328.x. [ DOI ] [ PubMed ] [ Google Académico ]
- 78.Pérez J. Terapia combinada con cannabinoides mediante aerosol oromucosal. Drugs Today. 2006;42:495–503. doi: 10.1358/dot.2006.42.8.1021517. [ DOI ] [ PubMed ] [ Google Académico ]
- 79.Collin C., Ehler E., Waberzinek G., Alsindi Z., Davies P., Powell K., Notcutt W., O'Leary C., Ratcliffe S., Nováková I., et al. Estudio doble ciego, aleatorizado, controlado con placebo y de grupos paralelos de Sativex en sujetos con síntomas de espasticidad debido a esclerosis múltiple. Neurol. Res. 2010;32:451–459. doi: 10.1179/016164109X12590518685660. [ DOI ] [ PubMed ] [ Google Académico ]
- 80.Langford RM, Mares J., Novotna A., Vachova M., Novakova I., Notcutt W., Ratcliffe S. Estudio doble ciego, aleatorizado, controlado con placebo y de grupos paralelos sobre el espray oromucosal de THC/CBD en combinación con el régimen de tratamiento existente para el alivio del dolor neuropático central en pacientes con esclerosis múltiple. J. Neurol. 2013;260:984–997. doi: 10.1007/s00415-012-6739-4. [ DOI ] [ PubMed ] [ Google Académico ]
- 81.Leocani L., Nuara A., Houdayer E. Efecto del aerosol oromucosal de THC-CBD (Sativex) en las medidas de espasticidad en la esclerosis múltiple: Un estudio cruzado, doble ciego y controlado con placebo; Actas de la Reunión del Comité Conjunto de las Américas para el Tratamiento e Investigación de la Esclerosis Múltiple (ACTRIMS) y el Comité Europeo para el Tratamiento e Investigación de la Esclerosis Múltiple (ECTRIMS); Boston, MA, EE. UU., 10-13 de septiembre de 2014. [ Google Académico ]
- 82.Wade DT, Makela PM, House H., Bateman C., Robson P. Uso a largo plazo de un medicamento a base de cannabis en el tratamiento de la espasticidad y otros síntomas de la esclerosis múltiple. Mult. Scler. J. 2006;12:639–645. doi: 10.1177/1352458505070618. [ DOI ] [ PubMed ] [ Google Académico ]
- 83.Collin C., Davies P., Mutiboko IK, Ratcliffe S., para el Grupo de Estudio de Espasticidad en EM con Sativex. Ensayo controlado aleatorizado de medicamentos a base de cannabis para la espasticidad causada por esclerosis múltiple. Eur. J. Neurol. 2007;14:290–296. doi: 10.1111/j.1468-1331.2006.01639.x. [ DOI ] [ PubMed ] [ Google Académico ]
- 84.Markovà J., Essner U., Akmaz B., Marinelli M., Trompke C., Lentschat A., Vila C. Sativex® como terapia complementaria frente a antiespásticos de primera línea optimizados (SAVANT) en la espasticidad resistente en la esclerosis múltiple: Un ensayo clínico aleatorizado, doble ciego y controlado con placebo. Int. J. Neurosci. 2019;129:119–128. doi: 10.1080/00207454.2018.1481066. [ DOI ] [ PubMed ] [ Google Académico ]
- 85.Meuth SG, Henze T., Essner U., Trompke C., Silván CV. Espray oromucosal de tetrahidrocannabinol y cannabidiol en la espasticidad resistente de la esclerosis múltiple: Consistencia de la respuesta entre subgrupos del ensayo clínico aleatorizado Savant. Int. J. Neurosci. 2020;130:1199–1205. doi: 10.1080/00207454.2020.1730832. [ DOI ] [ PubMed ] [ Google Académico ]
- 86.Potter DJ. Una revisión del cultivo y procesamiento de cannabis (Cannabis sativa L.) para la producción de medicamentos de prescripción en el Reino Unido. Drug Test. Anal. 2014;6:31–38. doi: 10.1002/dta.1531. [ DOI ] [ PubMed ] [ Google Académico ]
- 87.Rice J., Cameron M. Cannabinoides para el tratamiento de los síntomas de la EM: Estado de la evidencia. Curr. Neurol. Neurosci. Rep. 2018;18:1–10. doi: 10.1007/s11910-018-0859-x. [ DOI ] [ PubMed ] [ Google Académico ]
- 88.Rog DJ, Nurmikko TJ, Friede T., Young C. Ensayo controlado aleatorizado de medicamentos a base de cannabis para el dolor central en la esclerosis múltiple. Neurología. 2005;65:812–819. doi: 10.1212/01.wnl.0000176753.45410.8b. [ DOI ] [ PubMed ] [ Google Académico ]
- 89.Dykukha I., Malessa R., Essner U., Überall MA. Nabiximols en el dolor neuropático crónico: Un metaanálisis de ensayos aleatorizados controlados con placebo. Pain Med. 2021;22:861–874. doi: 10.1093/pm/pnab050. [ DOI ] [ PubMed ] [ Google Académico ]
- 90.Kavia R., De Ridder D., Constantinescu C., Stott C., Fowler C., Constantinescu C. Ensayo controlado aleatorizado de Sativex para el tratamiento de la hiperactividad del detrusor en la esclerosis múltiple. Mult. Scler. J. 2010;16:1349–1359. doi: 10.1177/1352458510378020. [ DOI ] [ PubMed ] [ Google Académico ]
- 91.Maniscalco GT, Aponte R., Bruzzese D., Guarcello G., Manzo V., Napolitano M., Moreggia O., Chiariello F., Florio C. Espray oromucosal de THC/CBD en pacientes con esclerosis múltiple y vejiga hiperactiva: Un estudio piloto prospectivo. Neurol. Sci. 2018;39:97–102. doi: 10.1007/s10072-017-3148-6. [ DOI ] [ PubMed ] [ Google Académico ]
- 92.Russo EB, Guy GW, Robson PJ. Cannabis, dolor y sueño: Lecciones de los ensayos clínicos terapéuticos de Sativex®, un medicamento a base de cannabis. Chem. Biodivers. 2007;4:1729–1743. doi: 10.1002/cbdv.200790150. [ DOI ] [ PubMed ] [ Google Académico ]
- 93.Flachenecker P., Henze T., Zettl UK Nabiximols (aerosol oromucosal de THC/CBD, Sativex®) en la práctica clínica: resultados de un estudio multicéntrico no intervencionista (MOVE 2) en pacientes con espasticidad por esclerosis múltiple. Eur. Neurol. 2014;71:271–279. doi: 10.1159/000357427. [ DOI ] [ PubMed ] [ Google Académico ]
- 94.Flachenecker P., Henze T., Zettl UK. Eficacia y seguridad a largo plazo de nabiximols (espray oromucosal de tetrahidrocannabinol/cannabidiol) en la práctica clínica. Eur. Neurol. 2014;72:95–102. doi: 10.1159/000360285. [ DOI ] [ PubMed ] [ Google Académico ]
- 95.Gado F., Digiacomo M., Macchia M., Bertini S., Manera C. Usos tradicionales de los cannabinoides y nuevas perspectivas en el tratamiento de la esclerosis múltiple. Medicines. 2018;5:91. doi: 10.3390/medicines5030091. [ DOI ] [ Artículo gratuito de PMC ] [ PubMed ] [ Google Académico ]
- 96.Ball S., Vickery J., Hobart J., Wright D., Green C., Shearer J., Nunn A., Cano MG, MacManus D., Miller D., et al. El ensayo CUPID: Un ensayo multicéntrico, aleatorizado, doble ciego, controlado con placebo, de grupos paralelos, sobre cannabinoides para ralentizar la progresión de la esclerosis múltiple. Health Technol. Assess. 2015;19:1–187. doi: 10.3310/hta19120. [ DOI ] [ Artículo gratuito de PMC ] [ PubMed ] [ Google Académico ]
- 97.Killestein J., Hoogervorst EL, Reif M., Kalkers NF, Van Loenen AC, Staats PG, Gorter RW, Uitdehaag BM, Polman CH Seguridad, tolerabilidad y eficacia de los cannabinoides administrados por vía oral en la EM. Neurología. 2002;58:1404–1407. doi: 10.1212/WNL.58.9.1404. [ DOI ] [ PubMed ] [ Google Scholar ]
- 98.Clifford DB: Tetrahidrocannabinol para el temblor en la esclerosis múltiple. Ann. Neurol. Off. J. Am. Neurol. Assoc. Child Neurol. Soc. 1983;13:669–671. doi: 10.1002/ana.410130616. [ DOI ] [ PubMed ] [ Google Académico ]
- 99.Killestein J. Efectos inmunomoduladores de los cannabinoides administrados por vía oral en la esclerosis múltiple. J. Neuroimmunol. 2003;137:140–143. doi: 10.1016/S0165-5728(03)00045-6. [ DOI ] [ PubMed ] [ Google Académico ]
- 100.Svendsen KB, Jensen TS, Bach FW: ¿Reduce el cannabinoide dronabinol el dolor central en la esclerosis múltiple? Ensayo cruzado, aleatorizado, doble ciego y controlado con placebo. BMJ. 2004;329:253. doi: 10.1136/bmj.38149.566979.AE. [ DOI ] [ Artículo gratuito de PMC ] [ PubMed ] [ Google Académico ]
- 101.Zajicek JP Estudio sobre cannabinoides en la esclerosis múltiple (CAMS): Datos de seguridad y eficacia durante 12 meses de seguimiento. J. Neurol. Neurosurg. Psychiatry. 2005;76:1664–1669. doi: 10.1136/jnnp.2005.070136. [ DOI ] [ Artículo gratuito de PMC ] [ PubMed ] [ Google Académico ]
- 102.Petro DJ, Ellenberger CJ. Tratamiento de la espasticidad humana con Δ9-tetrahidrocannabinol. J. Clin. Pharmacol. 1981;21:413S–416S. doi: 10.1002/j.1552-4604.1981.tb02621.x. [ DOI ] [ PubMed ] [ Google Académico ]
- 103.Ungerleider JT, Andyrsiak T., Fairbanks L., Ellison GW, Myers LW. Delta-9-THC en el tratamiento de la espasticidad asociada a la esclerosis múltiple. Adv. Alcohol Subst. Abus. 1987;7:39–50. doi: 10.1300/J251v07n01_04. [ DOI ] [ PubMed ] [ Google Académico ]
- 104.Freeman RM, Adekanmi O., Waterfield MR, Waterfield AE, Wright D., Zajicek J. El efecto del cannabis en la incontinencia de urgencia en pacientes con esclerosis múltiple: Un ensayo multicéntrico, aleatorizado y controlado con placebo (CAMS-LUTS). Int. Urogynecol. J. 2006;17:636–641. doi: 10.1007/s00192-006-0086-x. [ DOI ] [ PubMed ] [ Google Académico ]
- 105.Zajicek J., Ball S., Wright D., Vickery J., Nunn A., Miller D., Cano MG, McManus D., Mallik S., Hobart J. Efecto del dronabinol en la progresión de la esclerosis múltiple progresiva (CUPID): Un ensayo aleatorizado, controlado con placebo. Lancet Neurol. 2013;12:857–865. doi: 10.1016/S1474-4422(13)70159-5. [ DOI ] [ Artículo gratuito de PMC ] [ PubMed ] [ Google Académico ]
- 106.Schimrigk S., Marziniak M., Neubauer C., Kugler EM, Werner G., Abramov-Sommariva D. El dronabinol es una opción segura de tratamiento a largo plazo para pacientes con dolor neuropático. Eur. Neurol. 2017;78:320–329. doi: 10.1159/000481089. [ DOI ] [ Artículo gratuito de PMC ] [ PubMed ] [ Google Académico ]
- 107.Deutsch SI, Rosse RB, Connor JM, Burket JA, Murphy ME, Fox FJ. Estado actual del tratamiento con cannabis para la esclerosis múltiple con un caso ilustrativo de un paciente con EM, tics vocales complejos, distonía paroxística y dependencia de la marihuana tratado con dronabinol. CNS Spectr. Int. J. Neuropsychiatr. Med. 2008;13:393–403. doi: 10.1017/S1092852900016564. [ DOI ] [ PubMed ] [ Google Scholar ]
- 108.Martyn C., Illis L., Thom J. Nabilona en el tratamiento de la esclerosis múltiple. Lancet. 1995;345:579. doi: 10.1016/S0140-6736(95)90485-9. [ DOI ] [ PubMed ] [ Google Académico ]
- 109.Wissel J., Haydn T., Müller J., Brenneis C., Berger T., Poewe W., Schelosky LD. El tratamiento con dosis bajas del cannabinoide sintético nabilona reduce significativamente el dolor asociado con la espasticidad. J. Neurol. 2006;253:1337–1341. doi: 10.1007/s00415-006-0218-8. [ DOI ] [ PubMed ] [ Google Académico ]
- 110.Turcotte D., Doupe M., Torabi M., Gomori A., Ethans K., Esfahani F., Galloway K., Namaka M. Nabilona como tratamiento complementario a la gabapentina para el dolor neuropático inducido por esclerosis múltiple: Un ensayo controlado aleatorizado. Pain Med. 2015;16:149–159. doi: 10.1111/pme.12569. [ DOI ] [ PubMed ] [ Google Académico ]
- 111.Centonze D., Mori F., Koch G., Buttari F., Codecà C., Rossi S., Cencioni MT, Bari M., Fiore S., Bernardi G., et al. Ausencia de efecto del tratamiento con cannabis en las medidas clínicas y de laboratorio en la esclerosis múltiple. Neurol. Sci. 2009;30:531–534. doi: 10.1007/s10072-009-0136-5. [ DOI ] [ PubMed ] [ Google Académico ]
- 112.Zajicek JP, Hobart JC, Slade A., Barnes D., Mattison PG, en representación del Grupo de Investigación MUSEC. Esclerosis múltiple y extracto de cannabis: Resultados del ensayo MUSEC. J. Neurol. Neurosurg. Psychiatry. 2012;83:1125–1132. doi: 10.1136/jnnp-2012-302468. [ DOI ] [ PubMed ] [ Google Académico ]
- 113.Gustavsen S., Søndergaard H., Linnet K., Thomsen R., Rasmussen B., Sorensen P., Sellebjerg F., Oturai A. Seguridad y eficacia de los aceites de cannabis medicinal en dosis bajas en la esclerosis múltiple. Mult. Escler. Relacionado. Desorden. 2021;48:102708. doi: 10.1016/j.msard.2020.102708. [ DOI ] [ PubMed ] [ Google Scholar ]
- 114.Meza R., Peña J., García K., Corsi O., Rada G. ¿Son efectivos los cannabinoides en la esclerosis múltiple? Medwave. 2017;17:e6865. doi: 10.5867/medwave.2017.6865. [ DOI ] [ PubMed ] [ Google Académico ]
- 115.Castelli L., Prosperini L., Pozzilli C. Empeoramiento del equilibrio asociado con nabiximols en la esclerosis múltiple. Mult. Scler. J. 2019;25:113–117. doi: 10.1177/1352458518765649. [ DOI ] [ PubMed ] [ Google Académico ]
- 116.De Blasiis P., Siani MF, Fullin A., Sansone M., Melone MAB, Sampaolo S., Signoriello E., Lus G. Efectos a corto y largo plazo de Nabiximols en el equilibrio y la marcha, evaluados mediante análisis de la marcha 3D en personas con esclerosis múltiple y espasticidad. Mult. Scler. Relat. Disord. 2021;51:102805. doi: 10.1016/j.msard.2021.102805. [ DOI ] [ PubMed ] [ Google Scholar ]
- 117.Carotenuto A., Costabile T., De Lucia M., Moccia M., Falco F., Petruzzo M., De Angelis M., Russo CV, Saccà F., Lanzillo R., et al. Predictores de la interrupción del tratamiento con Nabiximols (Sativex®) durante el seguimiento a largo plazo: un estudio de la vida real. J. Neurol. 2020;267:1737–1743. doi: 10.1007/s00415-020-09739-x. [ DOI ] [ PubMed ] [ Google Scholar ]
- 118.Wade DT, Robson P., House H., Makela P., Aram J. Un estudio preliminar controlado para determinar si los extractos de cannabis de planta entera pueden mejorar los síntomas neurogénicos intratables. J. Clin. Rehab. 2003;17:21–29. doi: 10.1191/0269215503cr581oa. [ DOI ] [ PubMed ] [ Google Académico ]
- 119.Torres-Moreno MC, Papaseit E., Torrens M., Farré M. Evaluación de la eficacia y la tolerabilidad de los cannabinoides medicinales en pacientes con esclerosis múltiple: Una revisión sistemática y un metanálisis. JAMA Netw. Open. 2018;1:e183485. doi: 10.1001/jamanetworkopen.2018.3485. [ DOI ] [ Artículo gratuito de PMC ] [ PubMed ] [ Google Académico ]